1 . 风绪小组探究 的相关性质。
的相关性质。
(1)对于 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: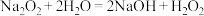 ,
,
①借助资料和实验,发现可以通过 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是_______ 。
②为验证资料的真实性,他们向溶液中滴加适量的酸性 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)_______ 。
(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
①先向沉淀中加入浓盐酸并加热,观察到有_______ 气体产生,发生反应_______ 。证明了猜想正确。
②后续得知,同学在制酸性 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了_______ 沉淀,并证明是 ,反应方程式是
,反应方程式是_______ 。
(3) 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和_______ 有关。
 的相关性质。
的相关性质。(1)对于
 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: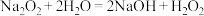 ,
,
①借助资料和实验,发现可以通过
 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是②为验证资料的真实性,他们向溶液中滴加适量的酸性
 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是
 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。①先向沉淀中加入浓盐酸并加热,观察到有
②后续得知,同学在制酸性
 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了 ,反应方程式是
,反应方程式是(3)
 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和
您最近一年使用:0次
解题方法
2 . 氯气的水溶液称为氯水,它是一种常用化学试剂,请回答下列问题:
(1)氯水的形成与保存:
①将氯气通入水中可制得氯水,写出氯气与水反应的化学方程式:_______ ;
②氯水的成分有_______ ;
③氯水应保存在_______ 试剂瓶中;其原理的离子方程式为:_______ ;
(2)设计简单的实验探究下列问题:
①氯水具有酸性:_______ 。
②氯水的漂白性是次氯酸所致:_______ 。
(1)氯水的形成与保存:
①将氯气通入水中可制得氯水,写出氯气与水反应的化学方程式:
②氯水的成分有
③氯水应保存在
(2)设计简单的实验探究下列问题:
①氯水具有酸性:
②氯水的漂白性是次氯酸所致:
您最近一年使用:0次
3 . 某试验小组利用如图装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。

(1)按图连接好实验装置。检查装置的气密性,方法是___ 。
(2)反应过程中末端导管必须插入试管A的水中,目的是___ 。
(3)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,___ ;
④拆除装置,取出产物。
(4)数据记录如下:
①计算得到实验式CaxN2,其中x=___ 。
②若通入的N2中混有少量O2,请比较x与3的大小:___ 。

(1)按图连接好实验装置。检查装置的气密性,方法是
(2)反应过程中末端导管必须插入试管A的水中,目的是
(3)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,
④拆除装置,取出产物。
(4)数据记录如下:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
②若通入的N2中混有少量O2,请比较x与3的大小:
您最近一年使用:0次
解题方法
4 . 氮化硼(BN) 是一种耐高温的绝缘材料,可用于制火箭喷嘴、燃料室的内衬。已知BN为白色难溶固体,不与 一般酸碱(HF除外)反应; B2O3易溶于水,熔点723 K,熔融时为玻璃状。实验室中可利用B2O3与NH3在高温下反应制得:B2O3+ 2NH3 2BN + 3H2O
2BN + 3H2O
实验时,称取适量B2O3和Ca3(PO4)2 (作为填料,它可降低B2O3熔体的黏度),用研钵将其研磨并混合均匀后转入瓷舟中,放入管式炉反应管的中部。按图所示接好装置,检查系统气密性良好后,接通管式炉电源加热升温,打开氨气钢瓶的阀门,控制温度在1100 K反应一定时间。
请回答下列问题:
(1)实验装置图中,a瓶和b瓶应分别装入什么试剂?各起什么作用?________ ;__________ ;________ ;__________ 。
(2)如何检查整个反应系统的气密性?__________ 。
(3)实验中,选择填料的原则是什么?若不加填料,实验会有什么不良后果?_____ ;________ 。
 2BN + 3H2O
2BN + 3H2O实验时,称取适量B2O3和Ca3(PO4)2 (作为填料,它可降低B2O3熔体的黏度),用研钵将其研磨并混合均匀后转入瓷舟中,放入管式炉反应管的中部。按图所示接好装置,检查系统气密性良好后,接通管式炉电源加热升温,打开氨气钢瓶的阀门,控制温度在1100 K反应一定时间。

请回答下列问题:
(1)实验装置图中,a瓶和b瓶应分别装入什么试剂?各起什么作用?
(2)如何检查整个反应系统的气密性?
(3)实验中,选择填料的原则是什么?若不加填料,实验会有什么不良后果?
您最近一年使用:0次
5 . 文献记载,铁粉在稀硝酸中会放出氢气。某同学进行如下验证和对比实验。
实验I. 室温下 (20℃), 在恒压密闭容器内放入过量铁粉和 2.0 mL 0.5 mol·L–1 HNO3,立即有气体生成。充分反应后,所得溶液几乎无色,收集到无色气体 6.0 mL。将该气体通入有空气的试管,无明显变化。点燃气体,有尖锐爆鸣声,试管壁出现液滴。取反应后溶液,加入足量 NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气略有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)气体产物为氢气的证据是______________________ 。
(2)根据实验现象, 写出铁粉与 0.5 mol·L–1 硝酸反应时还原反应的半反应方程式。① 2H+ + 2e– = H2↑; ②_____________ 。
(3)该同学对产生氢气的原因提出假设:
假设 1:该浓度的硝酸中 H+的氧化性大于NO3-;
假设 2: H+的还原速率大于NO3-的还原速率;
I. 验证假设 1:用____ (Cu或Mg)粉与_____ 硝酸反应,说明假设1不成立。实验证据是______________________ 。
II. 验证假设 2: 改变条件重复实验 I,结果如下(气体成分和溶液成分检验的现象与实验 I 相似)。
①根据实验现象,你认为假设2是否成立?简述理由。__________________________
②试分析温度对铁粉与硝酸反应生成氢气体积的影响。__________________________
(4)改用 3 mol·L–1 HNO3与过量铁粉反应, 有无色气体生成, 溶液变为深棕色。气体接触空气显红棕色,不可燃。 根据以上结论解释生成还原产物的原因__________________________
(5)综上所述,金属与硝酸生成氢气,需要控制哪些条件?__________________________________
实验I. 室温下 (20℃), 在恒压密闭容器内放入过量铁粉和 2.0 mL 0.5 mol·L–1 HNO3,立即有气体生成。充分反应后,所得溶液几乎无色,收集到无色气体 6.0 mL。将该气体通入有空气的试管,无明显变化。点燃气体,有尖锐爆鸣声,试管壁出现液滴。取反应后溶液,加入足量 NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气略有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)气体产物为氢气的证据是
(2)根据实验现象, 写出铁粉与 0.5 mol·L–1 硝酸反应时还原反应的半反应方程式。① 2H+ + 2e– = H2↑; ②
(3)该同学对产生氢气的原因提出假设:
假设 1:该浓度的硝酸中 H+的氧化性大于NO3-;
假设 2: H+的还原速率大于NO3-的还原速率;
I. 验证假设 1:用
II. 验证假设 2: 改变条件重复实验 I,结果如下(气体成分和溶液成分检验的现象与实验 I 相似)。
| 序号 | 金属状态 | 反应温度 | 实验现象 |
| a | 铁粉 | 40℃ | 溶液略带黄色,气体 3.4 mL。 |
| b | 铁粉 | 60℃ | 黄色溶液,气体 2.6 mL。 |
②试分析温度对铁粉与硝酸反应生成氢气体积的影响。
(4)改用 3 mol·L–1 HNO3与过量铁粉反应, 有无色气体生成, 溶液变为深棕色。气体接触空气显红棕色,不可燃。 根据以上结论解释生成还原产物的原因
(5)综上所述,金属与硝酸生成氢气,需要控制哪些条件?
您最近一年使用:0次
2018-05-16更新
|
359次组卷
|
2卷引用:第32届(2018年)化学奥林匹克竞赛北京地区预赛试题
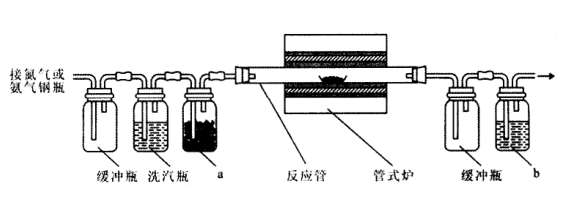
6 . 实验室里用乙醇和浓硫酸反应生成乙烯,接着再用溴与之反应生成1,2-二溴乙烷,在制备过程中有部分乙醇被浓硫酸氧化产生CO2、SO2,SO2进一步与Br2反应生成HBr等物质。
(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷.如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):_____ 经A(1)插入A中,_____ 接A(2);A(3)接_____ 接_____ 接_____ 接_____ (填各装置的代号)
(2)在三颈烧瓶A中的主要反应的化学方程式为_________________________ ;
(3)在反应管E中进行的主要反应的化学方程式为_________________________ ;
(4)温度计水银球的正确位置是_________________________ ;
(5)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为________________________ 。

(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷.如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):
(2)在三颈烧瓶A中的主要反应的化学方程式为
(3)在反应管E中进行的主要反应的化学方程式为
(4)温度计水银球的正确位置是
(5)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为
您最近一年使用:0次
2016-12-09更新
|
326次组卷
|
3卷引用:第17届(2003年)全国高中学生化学竞赛(江苏赛区)预赛试题



