1 . 某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
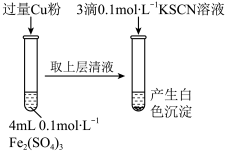
(1)Fe3+与Cu粉发生反应的离子方程式为__________________________________ 。
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:
已知:①SCN-的化学性质与I-相似;②2Cu2++4I-=2CuI↓+I2。
Cu2+与SCN-反应的离子方程式为________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO⇌Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;
反应Ⅱ:Fe2+与NO反应
①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ的____ (填“快”或“慢”)。
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明:___________________ 。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:_______________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)探究白色沉淀产生的原因,请填写实验方案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4 mL | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取 | 无明显现象 |
已知:①SCN-的化学性质与I-相似;②2Cu2++4I-=2CuI↓+I2。
Cu2+与SCN-反应的离子方程式为
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3 mL 0.1 mol·L-1 FeSO4溶液中加入1 mL稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO⇌Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;
反应Ⅱ:Fe2+与NO反应
①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ的
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明:
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:
您最近一年使用:0次
2021-08-09更新
|
991次组卷
|
15卷引用:【全国校级联考】江西省景德镇市第一中学等盟校2018届高三第二次联考理综化学试题
【全国校级联考】江西省景德镇市第一中学等盟校2018届高三第二次联考理综化学试题重庆市第一中学2017届高三下学期考前热身考试理科综合化学试题湖北省武汉市2018届高三毕业生二月调研理综化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三下学期一模考试理科综合化学试题2020届高三化学二轮复习实验题必练-化学平衡的移动及影响因素四川省成都市双流棠湖中学2020届高三下学期第三次月考理综化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市北京一零一中学2022-2023学年高二上学期期中考试化学试题(已下线)02 物质性质、实验原理的探究型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型32 原因描述型实验(已下线)实验探究题
名校
解题方法
2 . 某学校化学兴趣小组设计如下实验探究铁的电化学腐蚀原理。
(1)实验一:甲小组同学设计如图所示装置证明铁发生了电化学腐蚀。
①用电极反应解释实验a的现象:________ 。
②写出实验b中生成蓝色沉淀的离子方程式:________ 。
③已知 具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是
具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是_________ 。
(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入 的
的 溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
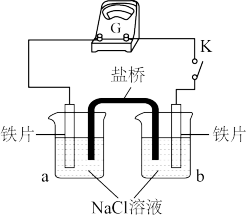
①分别取少量容器a、b中的溶液于试管中,滴加 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做_______ 极。
②加热后,电流计指针发生偏转的原因可能是_______ 。
(3)实验三:丙小组同学向如图所示装置的容器a、b中各加入 不同质量分数的
不同质量分数的 溶液,实验数据如表所示:
溶液,实验数据如表所示:
则实验Ⅱ的容器b中发生的电极反应是______ 。
(1)实验一:甲小组同学设计如图所示装置证明铁发生了电化学腐蚀。
装置 | 分别进行的实验 | 现象 |
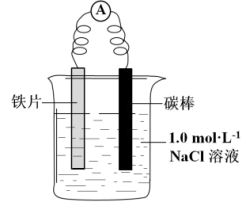 | a.连接好装置,一段时间后,向烧杯中滴加酚酞溶液 | 碳棒附近溶液变红 |
b连接好装置,一段时间后,向烧杯中滴加 溶液 溶液 | 铁片表面产生蓝色沉淀 |
①用电极反应解释实验a的现象:
②写出实验b中生成蓝色沉淀的离子方程式:
③已知
 具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是
具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入
 的
的 溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
①分别取少量容器a、b中的溶液于试管中,滴加
 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做②加热后,电流计指针发生偏转的原因可能是
(3)实验三:丙小组同学向如图所示装置的容器a、b中各加入
 不同质量分数的
不同质量分数的 溶液,实验数据如表所示:
溶液,实验数据如表所示:实验标号 | 容器a | 容器b | 电流计指针偏转方向 |
Ⅰ | 0.1% | 0.01% | 向右 |
Ⅱ | 0.1% | 3.5% | 向左 |
Ⅲ | 3.5% | 饱和溶液 | 向右 |
则实验Ⅱ的容器b中发生的电极反应是
您最近一年使用:0次
2020-09-19更新
|
282次组卷
|
4卷引用:鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护
名校
解题方法
3 . 在通风橱中进行下列实验:
下列说法正确的是( )
| 步骤 | 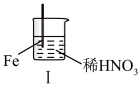 | 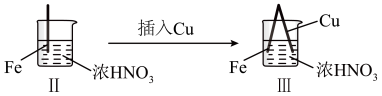 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=NO2 |
| B.Ⅱ中现象是因为浓HNO3会使Fe表面覆盖一层保护膜,阻止Fe进一步反应,此反应不属于氧化还原反应 |
| C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
| D.针对Ⅲ中现象,在Fe、Cu之间连接电流表,可判断Fe是否被氧化 |
您最近一年使用:0次
2020-05-11更新
|
595次组卷
|
3卷引用:辽宁省沈阳铁路实验中学2019-2020学年高一下学期期中考试化学试题
4 . 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
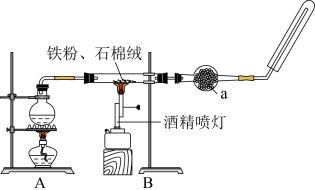
(1)该实验反应的反应方程式为:___ 。
(2)仪器a的名称是___ 。
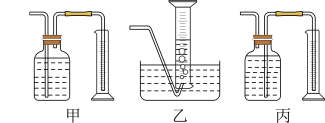
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__ (填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___ (填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__ 。(转化率= )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:


(1)该实验反应的反应方程式为:
(2)仪器a的名称是
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为
 )
)(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
| 步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
| Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ② | Ⅲ.反应后的溶液中阳离子为 |
| Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ① ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
您最近一年使用:0次
2019-12-17更新
|
314次组卷
|
3卷引用:江西省景德镇一中2019-2020学年高一上学期期末考试(1班)化学试题
名校
5 . 对下列实验现象解释正确的是
实验内容 | 实验现象 | 相关解释 | |
A | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
C | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2 2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性 2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2= Na2S2O5。
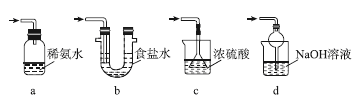
(1)装置Ⅰ中产生气体的化学方程式为______________________________ 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________ 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________ (填序号)。
实验二 焦亚硫酸钠的性质
已知:Na2S2O5溶于水即生成NaHSO3。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是____________________ 。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2= Na2S2O5。
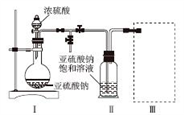
(1)装置Ⅰ中产生气体的化学方程式为
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为
实验二 焦亚硫酸钠的性质
已知:Na2S2O5溶于水即生成NaHSO3。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是
您最近一年使用:0次
2017-04-27更新
|
181次组卷
|
4卷引用:江西省景德镇市第一中学2016-2017学年高一(16班)下学期期中考试化学试题
江西省景德镇市第一中学2016-2017学年高一(16班)下学期期中考试化学试题山西省怀仁县第一中学2016-2017学年高一下学期期中考试化学试题(已下线)微专题23 新型含硫化合物的制备与性质探究(Na2S2O3 Na2S2O4 Na2S4O6 )-备战2022年高考化学考点微专题(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化
名校
7 . 锰的化合物种类较多,大多具有广泛的用途。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________ (填序号)。
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
①从以上实验中,我们可以得出的结论是_____________________ 。
②写出C试管中发生反应的离子方程式:_______________________ 。
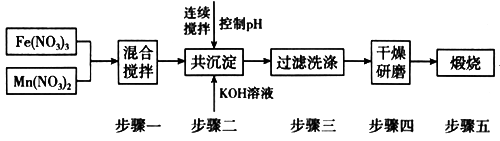
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
已知:Fe3+、Mn2+沉淀的pH如表格所示。
步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_________________ 。
步骤二中需控制pH的范围是_________________ 。
步骤三中是否洗涤干净的判断方法是_____________________ 。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |
①从以上实验中,我们可以得出的结论是
②写出C试管中发生反应的离子方程式:
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
已知:Fe3+、Mn2+沉淀的pH如表格所示。
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
步骤二中需控制pH的范围是
步骤三中是否洗涤干净的判断方法是
您最近一年使用:0次
2017-03-06更新
|
59次组卷
|
2卷引用:2016-2017学年江西省景德镇市第一中学高二(素质班)上学期期末考试化学试卷



