19-20高一·全国·单元测试
1 . 为了除去粗盐中的Ca2+、Mg2+、SO 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是_____________
(1)过滤;(2)加过量的NaOH溶液;(3)加适量HCl;(4)加过量的Na2CO3溶液;(5)加过量的BaCl2溶液
 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是(1)过滤;(2)加过量的NaOH溶液;(3)加适量HCl;(4)加过量的Na2CO3溶液;(5)加过量的BaCl2溶液
您最近一年使用:0次
名校
解题方法
2 . 从海水中提取下列物质,可以不涉及到化学变化的是( )
| A.Mg | B.NaCl | C.Br2 | D.K |
您最近一年使用:0次
2020-08-15更新
|
114次组卷
|
8卷引用:人教版高中化学必修2第四章《化学与自然资源的开发利用》测试题
名校
解题方法
3 . 下列离子在海水中含量最多的是
| A.氯离子 | B.镁离子 | C.铁离子 | D.钙离子 |
您最近一年使用:0次
2020-07-22更新
|
1000次组卷
|
6卷引用:第四章 非金属及其化合物(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)
(已下线)第四章 非金属及其化合物(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)【知识图鉴】单元讲练测必修第二册第八单元02基础练吉林省长春市第二十九中学2019-2020学年高一下学期第三次月考化学(文)试题(已下线)2.2.1氯气的性质(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)专题2.2.1 氯气的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题
4 . 从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:

(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________ (填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________ 。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________ 。
(4)从经济效益角度考虑,该化工厂厂址应选在________________ 。

(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为
(4)从经济效益角度考虑,该化工厂厂址应选在
您最近一年使用:0次
2020-04-19更新
|
286次组卷
|
3卷引用:必修第二册RJ高效学习手册-第八章
解题方法
5 . 实验室模拟由海水制备 溶液,其流程如下:
溶液,其流程如下:

下列有关说法正确的是( )
 溶液,其流程如下:
溶液,其流程如下:
下列有关说法正确的是( )
| A.步骤一用到的仪器有坩埚、三脚架和泥三角等 |
B.步骤二添加 的目的是除去 的目的是除去 |
| C.步骤二的过滤操作是在加入盐酸之后 |
D.步骤三中制取 的反应为 的反应为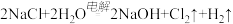 |
您最近一年使用:0次
2020-04-11更新
|
504次组卷
|
5卷引用:第八章 化学与可持续发展 综合拓展——B拓展区 夯实基础(人教版(2019)第二册)
6 . 从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
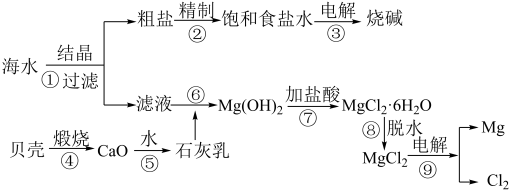
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是__________ (填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸、B.Na2CO3溶液、C.NaOH溶液)。请你正确排列加入的顺序:__________ (填编号);
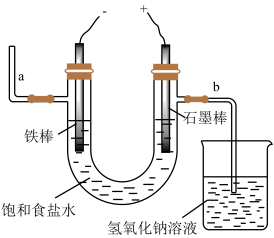
(3)用如图电解饱和食盐水,石墨棒上产生的气体为Cl2;在铁棒周围的溶液里滴加紫色石蕊试液,溶液变成_____________ 色;
(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为__________ (填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧

(1)上述流程图①~⑨步骤中,属于氧化还原反应的是
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸、B.Na2CO3溶液、C.NaOH溶液)。请你正确排列加入的顺序:

(3)用如图电解饱和食盐水,石墨棒上产生的气体为Cl2;在铁棒周围的溶液里滴加紫色石蕊试液,溶液变成
(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
您最近一年使用:0次
解题方法
7 . 海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性。请写出加入盐酸后发生反应的离子方程式:____________________________ 。
(2)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起____________ 作用?
(3)海水里的镁元素处于游离态还是化合态_________ ?从海水中提取氯化镁的反应是不是氧化还原反应_________ ?为什么_________________ ?
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却?________ 。
A.H2
B.CO2
C.空气
D.O2

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性。请写出加入盐酸后发生反应的离子方程式:
(2)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起
(3)海水里的镁元素处于游离态还是化合态
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却?
A.H2
B.CO2
C.空气
D.O2
您最近一年使用:0次
8 . 海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )

| A.海水提溴的过程中,没有发生氧化还原反应 |
| B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同 |
| C.从海水中可以得到NaCl,电解NaCl溶液可制备金属钠 |
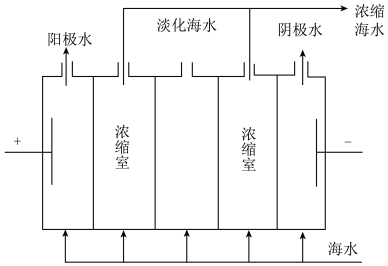
| D.如图,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,此法称为电渗析法 |
您最近一年使用:0次
解题方法
9 . 综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:

(1)贝壳主要成分的化学式是__ 。
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式:__ ,基本反应类型是__ 。
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式:__ ,该反应基本类型是__ 。
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:___ ,反应基本类型是__ 。
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量,确定海水中的MgCl2已全部转化为Mg(OH)2的方法:取上层清液少量,向其中加入氢氧化钠溶液,观察到__ 。
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:__ 。

(1)贝壳主要成分的化学式是
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式:
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式:
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量,确定海水中的MgCl2已全部转化为Mg(OH)2的方法:取上层清液少量,向其中加入氢氧化钠溶液,观察到
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:
您最近一年使用:0次
2020-01-29更新
|
114次组卷
|
2卷引用:鲁科版高中化学必修1第三章《自然界中的元素》测试卷
10 . 每次取20 g海水,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,平均得固态盐a g。该海水中含氯化钠的质量分数是( )
| A.大于5a% |
| B.小于5a% |
| C.等于5a% |
| D.无法判断 |
您最近一年使用:0次
2020-01-29更新
|
47次组卷
|
3卷引用:苏教版高中化学必修1专题一《化学家眼中的物质世界》测试卷



