四川省眉山市仁寿第二中学等三校2020-2021学年高一11月联考化学试题
四川
高一
阶段练习
2020-12-08
635次
整体难度:
适中
考查范围:
化学实验基础、化学与STSE、认识化学科学
一、单选题 添加题型下试题
| A.过滤 | B.萃取 | C.蒸发 | D.蒸馏 |
| A.240mL0.2mol/L的NaCl溶液配制:需要使用天平、250mL容量瓶等仪器 |
| B.不慎将NaOH溶液到皮肤上,应立即用较多的水冲洗 |
| C.用CCl4萃取碘水中的碘时,萃取后的CCl4层应从分液漏斗下端放出 |
| D.实验室酒精起火,可以用水浇灭 |
| A.0.4 mol氧气 | B.4℃时,5.4 mL H2O | C.标准状况下5.6 L二氧化碳 | D.10 g氖气 |
【知识点】 化学计量
| A.用蒸馏的方法制取蒸馏水 |
| B.用过滤的方法除去NaCl溶液中含有的少量Na2SO4 |
| C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D.用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
| A.需用托盘天平称量NaClO固体的质量为144 g |
| B.容量瓶用蒸馏水洗净后必须烘干才能用于配制溶液 |
| C.定容时俯视容量瓶的刻度线,会造成所配制溶液物质的量浓度偏低 |
| D.该消毒液的物质的量浓度约为4.0 mol·L-1 |
二、未知 添加题型下试题

| A.所含原子数相等 | B.气体密度相等 |
| C.气体质量相等 | D.平均摩尔质量相等 |
【知识点】 摩尔质量的概念解读 阿伏加德罗定律及其推论解读
三、单选题 添加题型下试题
| A.2 mol水的摩尔质量和1 mol水的摩尔质量 |
| B.200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-) |
| C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 |
| D.20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度 |
| A.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 |
| B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 |
| C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 |
| D.只有胶状的物质如胶水、果冻类的才能称为胶体 |
| A.凡是盐在离子方程式中都要以离子形式表示 |
| B.离子互换反应总是向着溶液中反应物离子浓度减小的方向进行 |
C.酸碱中和反应的实质是 与 与 结合生成水,故所有的酸碱中和反应的离子方程式都可写成 结合生成水,故所有的酸碱中和反应的离子方程式都可写成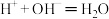 的形式 的形式 |
| D.复分解反应必须同时具备离子反应发生的三个条件才能进行 |
| A.N2 | B.N2O3 | C.HNO3 | D.NO2 |
四、未知 添加题型下试题

| A.A | B.B | C.C | D.D |
【知识点】 酸、碱、盐、氧化物的概念及其相互联系解读
五、单选题 添加题型下试题
| A.PbO2为还原剂,具有还原性 |
| B.氧化产物与还原产物的物质的量之比为5:2 |
| C.生成1 mol的Pb2+,转移电子5 mol |
| D.酸性环境下PbO2的氧化性强于MnO4- |
【知识点】 氧化还原反应基本概念 氧化还原反应的应用 氧化还原反应有关计算
A.硝酸银与盐酸反应:AgNO3+Cl-===AgCl↓+NO |
| B.铜片插入硝酸银溶液中:Cu+Ag+===Ag+Cu2+ |
C.硫酸和氯化钡溶液反应:Ba2++SO ===BaSO4↓ ===BaSO4↓ |
| D.铁钉放入硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
A.Cu2+、S 、OH-、K+ 、OH-、K+ | B.Fe3+、 、Cl-、H+ 、Cl-、H+ |
C.K+、C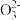 、Cl-、H+ 、Cl-、H+ | D.H+、Na+、Cl-、S |
【知识点】 离子反应的发生条件解读 限定条件下的离子共存解读
A. 溶液 溶液 溶液, 溶液, 溶液 溶液 溶液 溶液 |
B. 溶液 溶液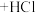 溶液, 溶液, 溶液+ 溶液+ 溶液 溶液 |
C. 溶液 溶液 溶液, 溶液, 溶液 溶液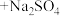 溶液 溶液 |
D. 溶液, 溶液, 溶液 溶液 溶液 溶液 |
【知识点】 离子反应的发生及书写 离子方程式的书写解读
| A.K2CrO4>H2O2>Ag2O | B.Ag2O>H2O2>K2CrO4 |
| C.H2O2>Ag2O> K2CrO4 | D.Ag2O>K2CrO4>H2O2 |
【知识点】 氧化性、还原性强弱的比较解读
| A.该反应的氧化剂只有Cu2O |
| B.Cu2S在反应中既是氧化剂,又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.每生成19.2gCu,反应中转移1.8mol电子 |
| A.①③ | B.①④ | C.②③ | D.②④ |
【知识点】 阿伏加德罗定律及其推论解读
| A. (b-a)/V mol·L-1 | B.(2b-a)/V mol·L-1 |
| C.2(2b-a)/V mol·L-1 | D.2(b-a)/V mol·L-1 |
六、解答题 添加题型下试题

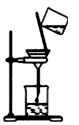
(1)从氯化钾溶液中得到氯化钾固体,选择装置
(2)从碘水中分离出I2,选择装置
(3)装置A中①的名称是
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释 ④转移、洗涤 ⑤定容、摇匀。
完成下列问题:
(1)所需浓硫酸的体积是
A.10 mL B.25 mL
C.50 mL D.100 mL
(2)第③步实验的具体操作是:
(3)第⑤步实验的具体操作是:继续往容量瓶中注入蒸馏水至离刻度线 1-2cm处。改用
(4)下列情况对所配制的稀硫酸浓度有何影响?用“偏大”“偏小”或“无影响”填写。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的凹液面
七、填空题 添加题型下试题
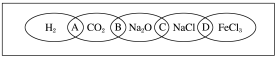
(1)请将分类依据代号填入相应的括号内。
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的上图中某种物质M的溶液,继续加热至呈红褐色。
①物质M的化学式为
②证明有红褐色胶体生成的实验操作是
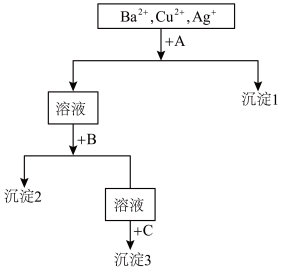
(1)沉淀的化学式:沉淀1
(2)写出混合液+A的离子方程式
【知识点】 离子反应在混合物分离、除杂中的应用解读
试卷分析
试卷题型(共 24题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 物质分离、提纯的常见物理方法 过滤 海水提取溴 海带中碘的提取及检验 | |
| 2 | 0.85 | 仪器使用与实验安全 一定物质的量浓度的溶液的配制 物质分离、提纯的常见物理方法 | |
| 3 | 0.85 | 常用仪器及使用 化学实验基础操作 实验安全 配制一定物质的量浓度的溶液实验的仪器 | |
| 4 | 0.94 | 化学计量 | |
| 5 | 0.65 | 物质的分离、提纯 物质分离、提纯的常见物理方法 物质分离、提纯的常见化学方法 | |
| 6 | 0.65 | 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度溶液的综合考查 | |
| 8 | 0.85 | 摩尔质量的概念 物质的量有关计算 物质的量浓度的计算 以N=m·NA/M为中心的有关基本粒子的推算 | |
| 9 | 0.85 | 溶液 分散系概念及其分类 胶体的定义及分类 胶体的性质和应用 | |
| 10 | 0.85 | 离子反应概念 离子反应的发生条件 | |
| 11 | 0.65 | 氧化还原反应基本概念 氧化还原反应的几组概念 氧化还原反应的规律 | |
| 13 | 0.85 | 氧化还原反应基本概念 氧化还原反应的应用 氧化还原反应有关计算 | |
| 14 | 0.85 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 15 | 0.85 | 离子反应的发生条件 限定条件下的离子共存 | |
| 16 | 0.85 | 离子反应的发生及书写 离子方程式的书写 | |
| 17 | 0.65 | 氧化性、还原性强弱的比较 | |
| 18 | 0.85 | 氧化还原反应的几组概念 氧化还原反应定义、本质及特征 电子转移计算 | |
| 19 | 0.65 | 阿伏加德罗定律及其推论 | |
| 20 | 0.65 | 物质的量浓度与溶质成分有关的计算 物质的量浓度与溶液混合的计算 离子反应在化合物组成的分析、鉴定的应用 | |
| 二、未知 | |||
| 7 | 0.65 | 摩尔质量的概念 阿伏加德罗定律及其推论 | 未知 |
| 12 | 0.94 | 酸、碱、盐、氧化物的概念及其相互联系 | 未知 |
| 三、解答题 | |||
| 21 | 0.65 | 蒸发与结晶 蒸馏与分馏 萃取和分液 过滤 | 实验探究题 |
| 22 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 四、填空题 | |||
| 23 | 0.65 | 酸、碱、盐、氧化物 胶体的性质和应用 胶体的制备 电解质与非电解质 | |
| 24 | 0.85 | 离子反应在混合物分离、除杂中的应用 | |