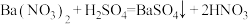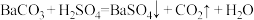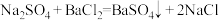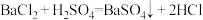云南省昭通市昭阳区第一中学2020-2021学年高一上学期期中考试化学试题
云南
高一
期中
2021-04-19
654次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
| A.侯德榜是我国化学工业的奠基人,纯碱工业的创始人,1943年创立侯氏制碱法又称联合制碱法,为我国化学工业作出重大贡献 |
| B.拉瓦锡提出原子学说,为近代化学的发展奠定了坚实基础 |
| C.研究物质的性质常用观察、实验、分类、比较等方法 |
| D.化学是在原子、分子的水平上研究物质的组成、结构、性质、变化、制备和应用的一门自然科学 |
| A.稀释浓硫酸时,将水沿器壁缓慢注入浓硫酸中 |
| B.过滤时,漏斗里液体的液面要高于滤纸的边缘 |
| C.实验室取用液体药品做实验时,如没有说明用量,一般取1~2 mL |
| D.胶头滴管的管口直接伸入试管里滴加液体,以免外溅 |
| A.32 g | B.34 g | C.32 g·mol-1 | D.34 g·mol-1 |
【知识点】 摩尔质量与相对原子质量区别与联系解读
| A.分子数 | B.原子总数 | C.密度 | D.质量 |
| A.摩尔是基本物理量之一 |
| B.1 mol H2O所含氧的质量为16 g |
| C.10 L H2比8 L H2所含H2的物质的量更多 |
| D.某物质含有6.02×1023个粒子,那么此物质所占的体积为22.4 L |
【知识点】 物质的量及单位——摩尔 阿伏加德罗常数 气体摩尔体积 阿伏加德罗常数的含义解读
| A.含有NA个原子的氢气在标准状况下的体积约为22.4 L |
| B.25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA |
| C.40 g NaOH溶解在1 L水中,则其100 mL溶液中含Na+数为0.1NA |
| D.标准状况下,11.2 L H2O含有的分子数为0.5NA |
【知识点】 阿伏加德罗常数
A.H+和 | B.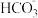 和 和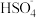 | C.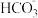 和H+ 和H+ | D.Na+、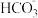 和H+ 和H+ |
【知识点】 离子反应的发生及书写 离子方程式的书写解读
| A.往澄清的石灰水中通入过量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |
| B.用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+=H2O+CO2↑ |
| C.往碳酸镁中滴加稀盐酸:CO32-+2H+=H2O+CO2↑ |
| D.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-+H++OH-=BaSO4+H2O |
A. 、 、 、Al3+、Cl- 、Al3+、Cl- | B.Na+、 、Ba2+、 、Ba2+、 |
C. 、K+、 、K+、 、Na+ 、Na+ | D.H+、 、 、 、Na+ 、Na+ |
【知识点】 限定条件下的离子共存解读
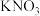 溶液中混有的少量
溶液中混有的少量 杂质,得到纯净的
杂质,得到纯净的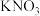 溶液,操作正确的是
溶液,操作正确的是A.加入适量的 溶液,过滤 溶液,过滤 |
B.加入足量的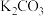 溶液,过滤 溶液,过滤 |
C.先加入过量的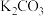 溶液,过滤,再向滤液中加入适量的稀硝酸 溶液,过滤,再向滤液中加入适量的稀硝酸 |
D.先加入过量的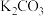 溶液,过滤,再向滤液中加入适量的稀盐酸 溶液,过滤,再向滤液中加入适量的稀盐酸 |
【知识点】 物质的分离、提纯
| A.Cl2是氧化剂,H2O是还原剂 |
| B.氧化剂与还原剂的物质的量之比是1∶2 |
| C.Cl2既是氧化剂又是还原剂 |
| D.按照化学方程式进行,氧化剂失电子1 mol |
【知识点】 氧化还原反应的几组概念解读 与氧化剂、还原剂有关的计算解读
A.Cl2 Cl— Cl— | B.H+ H2 H2 |
C.MnO2 Mn2+ Mn2+ | D.Zn Zn2+ Zn2+ |
【知识点】 氧化还原反应基本概念 氧化还原反应的规律解读
| A.该溶液物质的量浓度为 10 mol/L |
| B.该溶液物质的量浓度因溶液的体积未知而无法求得 |
| C.该溶液中溶质的质量分数因溶液的密度未知而无法求得 |
| D.所得溶液的体积为 22.5 L |
A.H2、CO2(CO)  |
B.H2(CO2、HCl)   |
C.O2(CO)   |
D.CO(H2O、CO2) 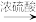  |
①在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
②使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
③清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
| A.只有① | B.①和② |
| C.②和③ | D.全部 |
| A.气体A与气体B的相对分子质量比为m:n |
| B.同质量气体A与气体B的分子个数比为n:m |
| C.同温同压下,A气体与B气体的密度比为n:m |
| D.相同状况下,同体积的A气体与B气体的质量比为m:n |
【知识点】 阿伏加德罗定律 阿伏加德罗定律及其推论解读 阿伏加德罗定律的应用解读
 5N2+6H2O中,氧化产物与还原产物的物质的量之比为( )
5N2+6H2O中,氧化产物与还原产物的物质的量之比为( )| A.1∶1 | B.2∶3 | C.3∶2 | D.1∶3 |
【知识点】 与氧化剂、还原剂有关的计算解读
 与单质R不反应;
与单质R不反应; ;
;  。下列氧化性顺序正确的是
。下列氧化性顺序正确的是A. | B. |
C. | D. |
【知识点】 氧化性、还原性强弱的比较解读 氧化还原反应的规律解读
| A.0.5 mol/L | B.0.2 mol/L |
| C.0.45 mol/L | D.0.25 mol/L |
| A.若有三支试管出现沉淀,则最后加入的是AgNO3溶液 |
| B.若全部没有明显现象,则最后加入的是NH4NO3溶液 |
| C.若一支试管出现气体,两支试管出现沉淀,则最后加入的是HCl溶液 |
| D.若只有两支试管出现沉淀,则最后加入的可能是BaCl2溶液 |
二、填空题 添加题型下试题

(1)图中所示的物质分类方法的名称是
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(4)实验室制备⑦常用
三、解答题 添加题型下试题

(1)双氧水(H2O2)是无色液体,可发生如下化学反应:
 。反应中MnO2的作用是
。反应中MnO2的作用是(2)KClO3在MnO2作催化剂时,加热也可以制得氧气。应选用的气体发生装置是
(3)为了验证MnO2在KClO3分解过程中起到了催化剂作用,我们要把反应后的产物分离,提取出MnO2并验证其的确是催化剂。分离出MnO2的操作有
(1)如何运用最简单的方法检验溶液中有无SO42—
(2)在除净SO42—且过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是
(3)将经过操作(2)后的溶液过滤。请问这一操作哪些杂质离子不能除净?
四、计算题 添加题型下试题
(1)氧化剂:
(2)标准状况下,生成3.36L H2,参加反应的Al的质量是
五、解答题 添加题型下试题
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是
(3)容量瓶使用前检验漏水的方法是
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,
②摇匀后发现液面低于刻度线再加水,
③容量瓶中原有少量蒸馏水,
④定容时观察液面俯视,
⑤未将洗涤液注入容量瓶中,
六、填空题 添加题型下试题
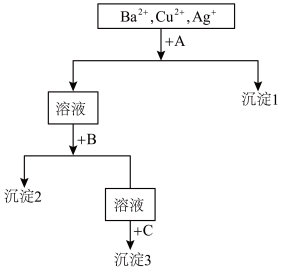
(1)沉淀的化学式:沉淀1
(2)写出混合液+A的离子方程式
【知识点】 离子反应在混合物分离、除杂中的应用解读
七、解答题 添加题型下试题
 2CO C+H2O(g)
2CO C+H2O(g) CO+H2】
CO+H2】
(1)写出装置A中所发生反应的离子方程式:
(2)装置B中最适宜的试剂是
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是
(4)按照如图装置进行实验时,首先进行的操作是
(5)根据实验中的
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置
①
 NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③ NaOH溶液 ④
NaOH溶液 ④ 浓H2SO4
浓H2SO4
八、计算题 添加题型下试题
(1)此BaCl2溶液的物质的量浓度是
(2)上述反应中生成的AgCl沉淀的质量是
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化学科学特点 化学研究基本方法 碳酸钠 | |
| 2 | 0.65 | 硫酸物理性质 化学实验基础操作 过滤 | |
| 3 | 0.85 | 摩尔质量与相对原子质量区别与联系 | |
| 4 | 0.65 | 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 根据n=N/NA进行相关计算 根据n=m/M进行相关计算 | |
| 5 | 0.94 | 物质的量及单位——摩尔 阿伏加德罗常数 气体摩尔体积 阿伏加德罗常数的含义 | |
| 6 | 0.4 | 阿伏加德罗常数 | |
| 7 | 0.94 | 离子反应的发生及书写 离子方程式的书写 | |
| 8 | 0.65 | 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 | |
| 9 | 0.85 | 限定条件下的离子共存 | |
| 10 | 0.85 | 物质的分离、提纯 | |
| 11 | 0.85 | 离子方程式的书写 | |
| 12 | 0.65 | 氧化还原反应的几组概念 与氧化剂、还原剂有关的计算 | |
| 13 | 0.85 | 氧化还原反应基本概念 氧化还原反应的规律 | |
| 14 | 0.85 | 依据物质的量浓度公式的基础计算 物质的量浓度计算-溶液配制有关计算 | |
| 15 | 0.65 | 常见气体的检验 物质检验和鉴别的基本方法选择及应用 物质检验和鉴别的实验方案设计 | |
| 16 | 0.65 | 胶体的性质和应用 胶体的制备 | |
| 17 | 0.65 | 阿伏加德罗定律 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 | |
| 18 | 0.65 | 与氧化剂、还原剂有关的计算 | |
| 19 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 20 | 0.65 | 物质的量浓度的基础计算 物质的量浓度与溶质成分有关的计算 | |
| 21 | 0.65 | 物质的检验 无机物的检验 | |
| 二、填空题 | |||
| 22 | 0.65 | 树状分类法 酸、碱、盐、氧化物的概念及其相互联系 常见气体的制备与收集 常见气体的检验 | |
| 27 | 0.85 | 离子反应在混合物分离、除杂中的应用 | |
| 三、解答题 | |||
| 23 | 0.65 | 常用仪器及使用 化学实验基础操作 物质分离、提纯综合应用 化学实验方案的设计与评价 | 实验探究题 |
| 24 | 0.65 | 硫酸根离子的检验 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 | 实验探究题 |
| 26 | 0.4 | 物质的量浓度计算-溶液配制有关计算 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | 实验探究题 |
| 28 | 0.4 | 常见气体的制备与收集 常见气体的检验 物质性质的探究 物质性质实验方案的设计 | 实验探究题 |
| 四、计算题 | |||
| 25 | 0.65 | 依据物质的量浓度公式的基础计算 氧化还原反应的几组概念 单线桥、双线桥分析氧化还原反应 与氧化剂、还原剂有关的计算 | |
| 29 | 0.4 | 根据n=m/M进行相关计算 化学方程式计算中物质的量的运用 依据物质的量浓度公式的基础计算 | |

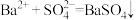 来表示的是
来表示的是