钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:

回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________ 。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________ 。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中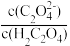 =
=__________ (保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式________________________ 。【已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5】
(4)草酸钪“灼烧”氧化的化学方程式为________________ 。

回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中
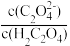 =
=(4)草酸钪“灼烧”氧化的化学方程式为
更新时间:2021-12-13 14:53:42
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:

回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________ (填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________ ;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________ ;
(3)操作2为______________________________ ;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________ ;
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________ ;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________ 。

回答下列问题:
(1)可以提高焙烧效率的措施有
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为
(3)操作2为
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】铋酸钠(NaBiO3)是常用的氧化剂,MnO2是活性电极。以辉铋矿(主要成分为Bi2S3,含FeS2、SiO2杂质)和软锰矿(主要成分是MnO2)为原料联合焙烧制备NaBiO3和MnO2,流程如下:
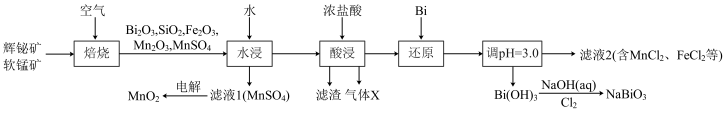
已知:①金属活动性:Fe>(H)>Bi>Cu。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1)NaBiO3中Bi的化合价为_____ 。气体X是_____ (填化学式)。
(2)“焙烧”中Bi2S3和MnO2与空气反应生成Bi2O3和MnSO4,写出其反应的化学方程式:_____ 。被还原的元素是_____ (填元素符号)。
(3)“还原”中Bi的作用是_____ 。
(4)检验滤液2中是否有FeCl3的试剂是_____ (填化学式)。
(5)已知Bi(OH)3难溶于水,NaBiO3难溶于冷水,写出冷水中利用Bi(OH)3制备NaBiO3的离子方程式:_____ 。
(6)为探究Cl2和NaBiO3的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:NaBiO3_____ Cl2(填“>”或“<”)。与根据第(5)小题得出的NaBiO3与Cl2氧化性强弱关系相反,其主要原因是_____ 。

已知:①金属活动性:Fe>(H)>Bi>Cu。
②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 6.3 | 8.3 |
| Mn2+ | 8.1 | 10.1 |
(1)NaBiO3中Bi的化合价为
(2)“焙烧”中Bi2S3和MnO2与空气反应生成Bi2O3和MnSO4,写出其反应的化学方程式:
(3)“还原”中Bi的作用是
(4)检验滤液2中是否有FeCl3的试剂是
(5)已知Bi(OH)3难溶于水,NaBiO3难溶于冷水,写出冷水中利用Bi(OH)3制备NaBiO3的离子方程式:
(6)为探究Cl2和NaBiO3的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:NaBiO3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】非金属元素及其化合物在生活、生产中有着重要的用途
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的最外层电子排布式为___________ ,已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是___________ 。
(2)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),CS2分子的空间构型为
CS2(g)+2H2S(g),CS2分子的空间构型为___________ ,用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________ 。
(3)中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。铁器表面氧化层的成分有多种,性质如下:
在有氧条件下,Fe3O4在含Cl–溶液中会转化为FeOCl,将相关反应的离子方程式补充完整___________ ,4Fe3O4 +_____O2 +______ +_____H2O _____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为
_____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为___________ 。
(4)化学修复可以使FeOCl转化为Fe3O4致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为FeO(OH),推测溶解度FeOCl___________ FeO(OH)(填“>”或“<”)。
② Na2SO3的作用是___________ 。
③ 检验FeOCl转化完全的操作和现象是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的最外层电子排布式为
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
金刚石熔点比晶体硅熔点高的原因是
(2)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)
 CS2(g)+2H2S(g),CS2分子的空间构型为
CS2(g)+2H2S(g),CS2分子的空间构型为(3)中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。铁器表面氧化层的成分有多种,性质如下:
| 成分 | Fe3O4 | FeO(OH) | FeOCl |
| 性质 | 致密 | 疏松 | 疏松 |
在有氧条件下,Fe3O4在含Cl–溶液中会转化为FeOCl,将相关反应的离子方程式补充完整
 _____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为
_____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为(4)化学修复可以使FeOCl转化为Fe3O4致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为FeO(OH),推测溶解度FeOCl
② Na2SO3的作用是
③ 检验FeOCl转化完全的操作和现象是
您最近一年使用:0次
【推荐1】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
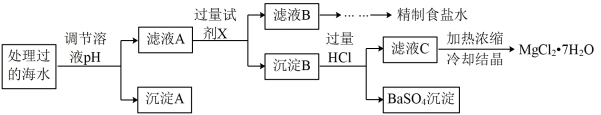
注:离子的浓度小于1.0×10−5mol·L−1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10−38,Ksp[Mg(OH)2]=5.0×10−12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=___________ 。沉淀A是___________ (填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_____ ;加入的过量试剂X为___________ (填化学式)。
(3)加入过量HCl的作用为___________ 。
| 离子 | SO | Mg2+ | Fe3+ | Na+ | Cl− |
| 浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:

注:离子的浓度小于1.0×10−5mol·L−1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10−38,Ksp[Mg(OH)2]=5.0×10−12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=
(2)在调节溶液pH时,理论上应调节的pH范围是
(3)加入过量HCl的作用为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(一)金属种类繁多,性质各异,应用十分广泛。
(1)将一小块金属钠分别放入下列溶液中,对应的现象正确的是_______
(2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是_______
(3)向某溶液中加入少量Na2O2后,原溶液中所含的下列离子浓度会显著改变的是_______
(二)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:室温下Ksp[Fe(OH)3]= 4.0×10-38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(4)FeCl3蚀刻铜箔反应的离子方程式为___________ :过程Ⅰ分离得到固体的主要成分是___________ 。
(5)过程Ⅱ中发生反应的化学方程式为___________ ;过程Ⅱ中调节溶液的pH为5,最终溶液中金属离子浓度为___________ 。(列式计算)
(6)有同学研究上述“过程Ⅱ”方案后,设计了下列方案:向滤液中加入足量的NaOH溶液使Fe2+完全沉淀,过滤,小心加热沉淀直到水分蒸干,再灼烧到质量不再变化。假设现有200mL0.1mol·L-1FeCl2溶液,按照上述操作,理想情况下,该同学应该得到的固体质量为___________ ;通过比较,说明石灰水—空气法与氢氧化钠—加热法相比的一个优点是___________ 。
(1)将一小块金属钠分别放入下列溶液中,对应的现象正确的是_______
| A.饱和NaOH溶液:产生气体,恢复至室温后溶液的pH增大 |
| B.稀CuSO4溶液:产生气体,有紫红色物质析出 |
| C.MgCl2溶液:产生气体,生成白色沉淀 |
| D.NH4NO3溶液:产生无色无味气体 |
(2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是_______
A.Na2O2的电子式为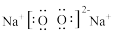 | B.H2O的空间构型为直线形 |
| C.H2O2中O元素的化合价为-1 | D.NaOH仅含离子键 |
(3)向某溶液中加入少量Na2O2后,原溶液中所含的下列离子浓度会显著改变的是_______
A.NO | B.NH | C.HCO | D.SO |
(二)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:室温下Ksp[Fe(OH)3]= 4.0×10-38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(4)FeCl3蚀刻铜箔反应的离子方程式为
(5)过程Ⅱ中发生反应的化学方程式为
(6)有同学研究上述“过程Ⅱ”方案后,设计了下列方案:向滤液中加入足量的NaOH溶液使Fe2+完全沉淀,过滤,小心加热沉淀直到水分蒸干,再灼烧到质量不再变化。假设现有200mL0.1mol·L-1FeCl2溶液,按照上述操作,理想情况下,该同学应该得到的固体质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________ 。
(2)“滤液②”中含有的金属离子是______________ 。
(3)“转化”中可替代H2O2的物质是______________ 。若工艺流程改为先“调pH”后“转化”,即
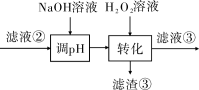
“滤液③”中可能含有的杂质离子为______________ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________ (列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是______________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01 mol·L−1)的pH 沉淀完全时(c=1.0×10−5 mol·L−1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代H2O2的物质是

“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算Ni(OH)2的Ksp=
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】 是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯
是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯 。已知:
。已知:
① ,合适反应温度为
,合适反应温度为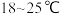 ;副反应:
;副反应: 。
。
②常压下, 沸点
沸点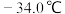 ,熔点
,熔点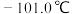 ;
; 沸点2.0℃,熔点
沸点2.0℃,熔点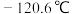 。
。
③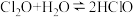 ,
, 在
在 中的溶解度远大于其在水中的溶解度。
中的溶解度远大于其在水中的溶解度。

请回答:
(1)①装置A的作用是去除原料气中的少量水分,可用的试剂是___________ 。
②将上图中装置组装完整,虚框D中应选用___________ 。

(2)有关反应柱B,须进行的操作是___________。
(3)装置C,冷却液的温度通常控制在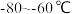 。反应停止后,温度保持不变,为减少产品中的
。反应停止后,温度保持不变,为减少产品中的 含量,可采用的方法是
含量,可采用的方法是___________ 。
(4)将纯化后的 产品气化,通入水中得到高纯度
产品气化,通入水中得到高纯度 的浓溶液,于阴凉暗处贮存。当需要
的浓溶液,于阴凉暗处贮存。当需要 时,可将
时,可将 浓溶液用
浓溶液用 萃取分液,经气化重新得到。
萃取分液,经气化重新得到。
针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:_______ 。
c→______→______→e→d→f→_______。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和 转入分液漏斗
转入分液漏斗
c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
 是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯
是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯 。已知:
。已知:①
 ,合适反应温度为
,合适反应温度为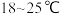 ;副反应:
;副反应: 。
。②常压下,
 沸点
沸点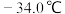 ,熔点
,熔点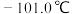 ;
; 沸点2.0℃,熔点
沸点2.0℃,熔点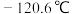 。
。③
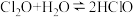 ,
, 在
在 中的溶解度远大于其在水中的溶解度。
中的溶解度远大于其在水中的溶解度。
请回答:
(1)①装置A的作用是去除原料气中的少量水分,可用的试剂是
②将上图中装置组装完整,虚框D中应选用

(2)有关反应柱B,须进行的操作是___________。
| A.将HgO粉末热处理除水分、增加表面积后填入反应柱 |
B.调控进入反应柱的混合气中 和 和 的比例 的比例 |
| C.调控混合气从下口进入反应柱的流速 |
| D.将加热带缠绕于反应柱并加热 |
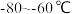 。反应停止后,温度保持不变,为减少产品中的
。反应停止后,温度保持不变,为减少产品中的 含量,可采用的方法是
含量,可采用的方法是(4)将纯化后的
 产品气化,通入水中得到高纯度
产品气化,通入水中得到高纯度 的浓溶液,于阴凉暗处贮存。当需要
的浓溶液,于阴凉暗处贮存。当需要 时,可将
时,可将 浓溶液用
浓溶液用 萃取分液,经气化重新得到。
萃取分液,经气化重新得到。针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:
c→______→______→e→d→f→_______。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和
 转入分液漏斗
转入分液漏斗c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】膨松剂反应时产生气体的量是检验膨松剂品质的一项重要指标。某校兴趣小组设计如图所示实验装置,通过测量某膨松剂加热反应产生气体的质量,确定其纯度。(已知该膨松剂中发挥作用的物质为NaHCO3,其他成分在加热条件下不产生气体。)

(1)实验步骤:
①组装实验装置,检验气密性。
②加药品。A中应加入________ ,C中药品的作用为______________ ,D和E中加入碱石灰,硬质玻璃管B加入ag样品。实验前称量装置D的质量为mg。
③连接装置后,打开铁夹_____ ,关闭____ (填“K1”“K2”或K3”),缓缓鼓入空气数分钟。
④关闭铁夹K1、K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤继续关闭铁夹K2,打开K1和K3,缓缓鼓入空气数分钟,其目的是___________ ,然后拆下装置,再次称量装置D的质量为ng。
(2)关于该实验方案,请回答下列问题。
①若加热反应前不鼓入空气,则会导致测量结果___ (填“偏大”“偏小”或“无影响”,②同)。
②该膨松剂的纯度为________ (用含a、m、n的代数式表示)。

(1)实验步骤:
①组装实验装置,检验气密性。
②加药品。A中应加入
③连接装置后,打开铁夹
④关闭铁夹K1、K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤继续关闭铁夹K2,打开K1和K3,缓缓鼓入空气数分钟,其目的是
(2)关于该实验方案,请回答下列问题。
①若加热反应前不鼓入空气,则会导致测量结果
②该膨松剂的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】如图是中学化学中常用于混合物分离和提纯的装置,请根据装置回答问题:
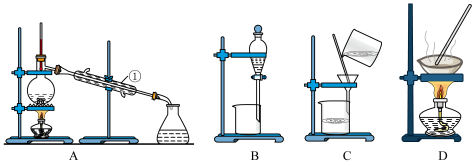
(1)在装置C和D中都用到玻璃棒,装置C中玻璃棒的作用是___________ ,装置D中玻璃棒的作用是___________ 。
(2)装置A中的①的名称是是___________ ,冷却水的方向是___________ 。装置B在分液时为是液体顺利滴下,应进行的操作是______________________ 。
(3)从氯化钠溶液中得到氯化钠固体,应选择___________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置__________ 。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加___________ ,不产生白色沉淀表明Cl-已除净;从碘水中分离出I2,选择装置___________ ,该分离方法的名称是________ 。

(1)在装置C和D中都用到玻璃棒,装置C中玻璃棒的作用是
(2)装置A中的①的名称是是
(3)从氯化钠溶液中得到氯化钠固体,应选择
您最近一年使用:0次
【推荐1】中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ∙mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ∙mol-1
③H2O(g)=H2O(l) ΔH=-44.0kJ∙mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式___________ 。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如图所示。
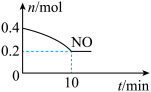
①写出该反应的化学方程式___________ 。
②10min内该反应的速率v(N2)=___________ ;T℃时该化学反应的平衡常数K=___________ 。
③若该反应ΔH<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是___________ 。
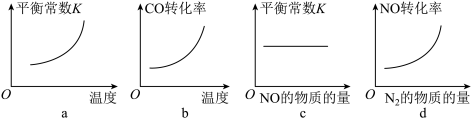
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是___________ 。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡___________ 移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中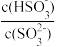 =
=___________ 。SO2可用足量小苏打溶液吸收,反应的离子方程式是___________ 。(已知该温度下,H2SO3的电离常数:K1=4.5×10-2,K2=2.5×10-7,H2CO3的电离常数K1=8.4×10-7,K2=1.2×10-10)
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ∙mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ∙mol-1
③H2O(g)=H2O(l) ΔH=-44.0kJ∙mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式
②10min内该反应的速率v(N2)=
③若该反应ΔH<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡
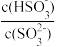 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
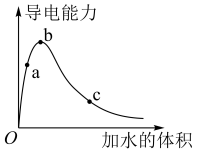
(1)a、b、c三点醋酸电离程度由大到小的顺序为___________ ;a、b、c三点对应的溶液中 最大的是
最大的是___________ 。
(2)常温下, 溶液的
溶液的
①该溶液中由水电离出的 浓度是
浓度是___________  。
。
②计算 的电离平衡常数
的电离平衡常数
___________ 。
(3)常温下在c点对应的溶液中加水稀释过程中,下列表达式的数值一定变小的是___________。
(4)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
①根据电离常数判断下列反应不可能发生的是___________
A.
B.
C.
D.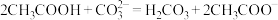
②25℃时,pH相等的三种溶液① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液,浓度由大到小的顺序为
溶液,浓度由大到小的顺序为___________ (填序号)。
③25℃时,向 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。

(1)a、b、c三点醋酸电离程度由大到小的顺序为
 最大的是
最大的是(2)常温下,
 溶液的
溶液的
①该溶液中由水电离出的
 浓度是
浓度是 。
。②计算
 的电离平衡常数
的电离平衡常数
(3)常温下在c点对应的溶液中加水稀释过程中,下列表达式的数值一定变小的是___________。
A. | B. | C.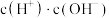 | D. |
(4)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |  |  |  |
| 电离平衡常数 |  | 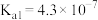  | 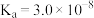 |
A.

B.

C.

D.
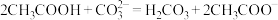
②25℃时,pH相等的三种溶液①
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液,浓度由大到小的顺序为
溶液,浓度由大到小的顺序为③25℃时,向
 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】常温下,以酚酞为指示剂,用 的
的 溶液滴定
溶液滴定 未知浓度
未知浓度 溶液。溶液
溶液。溶液 和微粒分布系数
和微粒分布系数 随滴加
随滴加 溶液体积
溶液体积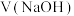 的变化关系如下图所示。
的变化关系如下图所示。


已知:ⅰ.二元酸 在水中的电离方程式是:
在水中的电离方程式是: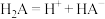 ,
, 。
。
ⅱ. 的分布系数
的分布系数
(1)滴定时, 的
的 溶液装入滴定管
溶液装入滴定管_______ 中(填“a”或“b”)。
(2)实验测得, 溶液的浓度为
溶液的浓度为_______  。
。
(3)曲线①代表_______ (填“ ”、“
”、“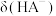 ”或“
”或“ ”)。
”)。
(4)常温下 的电离平衡常数
的电离平衡常数
_______ 。
(5)当 时,下列正确的是
时,下列正确的是_______ (填字母)。
a.溶液为红色
b.
c.
d.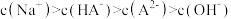
(6)下列情况会造成测定结果偏高的是_______ (填字母)。
a.盛装 溶液的滴定管,未用
溶液的滴定管,未用 溶液润洗
溶液润洗
b.盛装 溶液的锥形瓶,用蒸馏水洗过后未用
溶液的锥形瓶,用蒸馏水洗过后未用 溶液润洗
溶液润洗
c.盛装 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失
d.滴定终点读数时,俯视滴定管的刻度
 的
的 溶液滴定
溶液滴定 未知浓度
未知浓度 溶液。溶液
溶液。溶液 和微粒分布系数
和微粒分布系数 随滴加
随滴加 溶液体积
溶液体积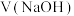 的变化关系如下图所示。
的变化关系如下图所示。

已知:ⅰ.二元酸
 在水中的电离方程式是:
在水中的电离方程式是: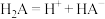 ,
, 。
。ⅱ.
 的分布系数
的分布系数
(1)滴定时,
 的
的 溶液装入滴定管
溶液装入滴定管(2)实验测得,
 溶液的浓度为
溶液的浓度为 。
。(3)曲线①代表
 ”、“
”、“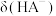 ”或“
”或“ ”)。
”)。(4)常温下
 的电离平衡常数
的电离平衡常数
(5)当
 时,下列正确的是
时,下列正确的是a.溶液为红色
b.

c.

d.
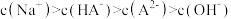
(6)下列情况会造成测定结果偏高的是
a.盛装
 溶液的滴定管,未用
溶液的滴定管,未用 溶液润洗
溶液润洗b.盛装
 溶液的锥形瓶,用蒸馏水洗过后未用
溶液的锥形瓶,用蒸馏水洗过后未用 溶液润洗
溶液润洗c.盛装
 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失d.滴定终点读数时,俯视滴定管的刻度
您最近一年使用:0次



