1 . 微生物反应器去除废水中铵盐和甲烷的过程如图。
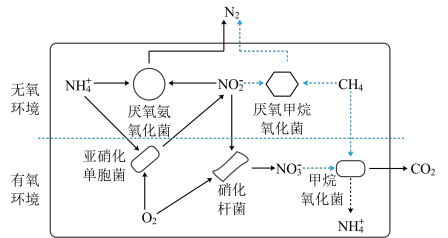
回答下列问题:
(1) 的电离方程式为
的电离方程式为_______ 。
(2)Cu和稀硝酸反应的化学方程式为_______ ,反应过程体现了硝酸性质中的________ 。
(3)在厌氧氨氧化菌作用下,转移 电子时产生
电子时产生 的物质的量为
的物质的量为_______ 。
(4)甲烷属于________ (填“电解质”或“非电解质”)。在酸性废水中,甲烷氧化菌催化甲烷转化的离子方程式为_______ 。

回答下列问题:
(1)
 的电离方程式为
的电离方程式为(2)Cu和稀硝酸反应的化学方程式为
(3)在厌氧氨氧化菌作用下,转移
 电子时产生
电子时产生 的物质的量为
的物质的量为(4)甲烷属于
您最近半年使用:0次
解题方法
2 . 一种利用 和
和 进行新型脱氮的过程如下图所示。下列说法正确的是
进行新型脱氮的过程如下图所示。下列说法正确的是
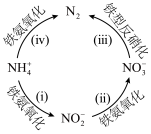
 和
和 进行新型脱氮的过程如下图所示。下列说法正确的是
进行新型脱氮的过程如下图所示。下列说法正确的是
A.铁氨氧化中, 转化为 转化为 |
B.将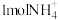 转化为 转化为 ,两个途径最终失去的电子数相同 ,两个途径最终失去的电子数相同 |
C.反应iii的离子方程式为 |
| D.四步反应中,氮元素均被氧化 |
您最近半年使用:0次
名校
3 . 某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是


A.“焙烧”中产生 |
B.滤渣的主要成分为 |
C.滤液①中 元素的主要存在形式为 元素的主要存在形式为 |
| D.淀粉水解液中的葡萄糖起还原作用 |
您最近半年使用:0次
2024-02-12更新
|
171次组卷
|
2卷引用:福建师范大学附属中学2023-2024学年高三上学期12月月考化学试卷
解题方法
4 . 某同学做实验时不小心沾了一些 ,皮肤上的黑斑要很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,离子方程式为
,皮肤上的黑斑要很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,离子方程式为 ______(未配平)。下列关于此反应的叙述正确的是
______(未配平)。下列关于此反应的叙述正确的是
 ,皮肤上的黑斑要很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,离子方程式为
,皮肤上的黑斑要很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,离子方程式为 ______(未配平)。下列关于此反应的叙述正确的是
______(未配平)。下列关于此反应的叙述正确的是A.该反应的氧化产物是 | B. 在反应中得到 在反应中得到 |
C.该反应方程式中横线上的产物是 | D.配平该反应后, 的化学计量数是8 的化学计量数是8 |
您最近半年使用:0次
名校
解题方法
5 . 氧化还原反应是一类非常重要的反应。回答下列问题:
(1)将铁丝伸入CuSO4溶液中,发生反应的离子方程式为_______ 。
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在,其中Fe2+易被人体吸收。服用维生素C可使Fe3+转化成Fe2+而有利于人体吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
(3)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为_______ 。
(4)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
①_______ 元素被氧化,发生氧化反应的物质是_______ 。
②请写出该反应的离子方程式_______ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效的净水剂,具有很强的氧化性,与盐酸混合会生成Cl2,本身被还原为Fe3+,请写出该反应的离子方程式_______ 。
(1)将铁丝伸入CuSO4溶液中,发生反应的离子方程式为
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在,其中Fe2+易被人体吸收。服用维生素C可使Fe3+转化成Fe2+而有利于人体吸收,说明维生素C具有
(3)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为
(4)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:①
②请写出该反应的离子方程式
(5)高铁酸钾(K2FeO4)是一种新型、高效的净水剂,具有很强的氧化性,与盐酸混合会生成Cl2,本身被还原为Fe3+,请写出该反应的离子方程式
您最近半年使用:0次
名校
6 . 现有以下物质:① ②Cu③
②Cu③ ④
④ 胶体⑤
胶体⑤ 溶液⑥干冰⑦稀硝酸⑧乙醇⑨熔融碳酸钠。回答下列问题:
溶液⑥干冰⑦稀硝酸⑧乙醇⑨熔融碳酸钠。回答下列问题:
(1)以上物质中属于电解质的是_______ (填序号,下同);上述状态下能导电的是________ 。
(2)①的电离方程式为___________ 。
(3)向④中逐滴滴加⑦,可观察到的现象是___________ 。
(4)⑤中混有少量①,除杂过程中选用的试剂为___________ 。
(5)③可发生如下反应 (未配平);配平该反应并用双线桥法分析电子转移的情况:
(未配平);配平该反应并用双线桥法分析电子转移的情况:________ ;每生成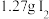 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为________ 。
 ②Cu③
②Cu③ ④
④ 胶体⑤
胶体⑤ 溶液⑥干冰⑦稀硝酸⑧乙醇⑨熔融碳酸钠。回答下列问题:
溶液⑥干冰⑦稀硝酸⑧乙醇⑨熔融碳酸钠。回答下列问题:(1)以上物质中属于电解质的是
(2)①的电离方程式为
(3)向④中逐滴滴加⑦,可观察到的现象是
(4)⑤中混有少量①,除杂过程中选用的试剂为
(5)③可发生如下反应
 (未配平);配平该反应并用双线桥法分析电子转移的情况:
(未配平);配平该反应并用双线桥法分析电子转移的情况: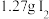 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为
您最近半年使用:0次
7 . 利用某钒废渣(主要成分为 、
、 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下:
的工艺流程如下: 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;
Ⅱ. 。
。
回答下列问题:
(1)为加快“氧化1”速率,可以采取的措施有____________________ (写出一条即可),该过程发生反应的离子方程式为______________________________ 。
(2)滤渣2的主要成分为____________________ 。
(3)实验室进行萃取、分液操作时,需要的玻璃仪器有____________________ 。
(4)“氧化2”中发生反应的离子方程式为______________________________ 。
(5)“沉钒”前若滤液中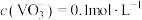 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中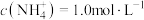 ,则钒元素的沉降率=
,则钒元素的沉降率=__________ %[ ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。
(6)在Ar气氛中“煅烧” 生成
生成 ,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式______________________________ 。
 、
、 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下:
的工艺流程如下: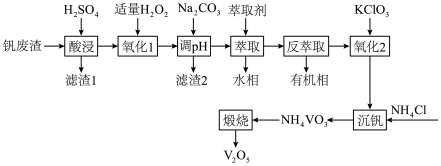
 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;Ⅱ.
 。
。回答下列问题:
(1)为加快“氧化1”速率,可以采取的措施有
(2)滤渣2的主要成分为
(3)实验室进行萃取、分液操作时,需要的玻璃仪器有
(4)“氧化2”中发生反应的离子方程式为
(5)“沉钒”前若滤液中
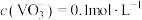 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中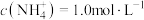 ,则钒元素的沉降率=
,则钒元素的沉降率= ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。(6)在Ar气氛中“煅烧”
 生成
生成 ,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
您最近半年使用:0次
2024-02-01更新
|
105次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
8 . 回答下列问题:
I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比 Cl2、O2、ClO2、KMnO4 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH 至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是_____ 。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式_____ 。
②每生成1molFeO 转移
转移_____ 个电子。
(3) 是一种有毒气体,如果泄漏会造成严重的危害。已知
是一种有毒气体,如果泄漏会造成严重的危害。已知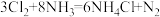 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。反应中被氧化和未被氧化的
是否泄漏。反应中被氧化和未被氧化的 分子个数比为
分子个数比为_____ 。
Ⅱ.用电弧法合成碳纳米管,常伴有大量杂质—碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应方程式为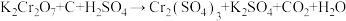 。
。
(4)配平该反应方程式:_____ 。
(5)此反应的氧化产物为_____ 。
(6)KMnO4在加热的条件下与硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,该反应的离子方程式为:_____ 。
(7)某条件下, 氧气所占的体积为
氧气所占的体积为 ,则在该条件下的气体摩尔体积为
,则在该条件下的气体摩尔体积为_____ 。
I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比 Cl2、O2、ClO2、KMnO4 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH 至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式
②每生成1molFeO
 转移
转移(3)
 是一种有毒气体,如果泄漏会造成严重的危害。已知
是一种有毒气体,如果泄漏会造成严重的危害。已知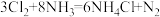 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。反应中被氧化和未被氧化的
是否泄漏。反应中被氧化和未被氧化的 分子个数比为
分子个数比为Ⅱ.用电弧法合成碳纳米管,常伴有大量杂质—碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应方程式为
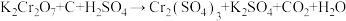 。
。(4)配平该反应方程式:
(5)此反应的氧化产物为
(6)KMnO4在加热的条件下与硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,该反应的离子方程式为:
(7)某条件下,
 氧气所占的体积为
氧气所占的体积为 ,则在该条件下的气体摩尔体积为
,则在该条件下的气体摩尔体积为
您最近半年使用:0次
9 . 按要求写出反应方程式:
(1)写出硫酸氢铵在水中的电离方程式:___________ 。
(2)过氧化钠可作为供氧剂吸收二氧化碳,请写出化学方程式,并用单线桥法标出电子转移___________ 。
(3)漂白粉在空气中会逐渐吸收CO2变质生成碳酸钙,请写出化学方程式:___________ 。
(4)FeSO4溶液能够使酸性KMnO4溶液褪色,请写出反应的离子方程式___________ 。
(5)配平下面的方程式:___________ 。
______Au2O3+______Na2S2O3+______NaOH=______Au2O+______Na2SO4+______H2O
(1)写出硫酸氢铵在水中的电离方程式:
(2)过氧化钠可作为供氧剂吸收二氧化碳,请写出化学方程式,并用单线桥法标出电子转移
(3)漂白粉在空气中会逐渐吸收CO2变质生成碳酸钙,请写出化学方程式:
(4)FeSO4溶液能够使酸性KMnO4溶液褪色,请写出反应的离子方程式
(5)配平下面的方程式:
______Au2O3+______Na2S2O3+______NaOH=______Au2O+______Na2SO4+______H2O
您最近半年使用:0次
解题方法
10 . 回答下列问题。
(1)已知H2O2是二元弱酸,请写出H2O2与NaOH溶液反应生成酸式盐的化学方程式_______ 。
(2)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题:
①用双线桥法标明上述反应方程式中电子转移的方向和数目___________ 。
②上述反应中氧化剂是___________ ,每生成1molCO2,转移电子数目为___________ 。
(3)高铁酸钾K2FeO4是新型高效多功能的绿色消毒剂,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、Cl-、OH-、ClO-、H2O、 ,写出湿法制备高铁酸钾的离子方程式:
,写出湿法制备高铁酸钾的离子方程式:___________ 。
(1)已知H2O2是二元弱酸,请写出H2O2与NaOH溶液反应生成酸式盐的化学方程式
(2)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题:
①用双线桥法标明上述反应方程式中电子转移的方向和数目
②上述反应中氧化剂是
(3)高铁酸钾K2FeO4是新型高效多功能的绿色消毒剂,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、Cl-、OH-、ClO-、H2O、
 ,写出湿法制备高铁酸钾的离子方程式:
,写出湿法制备高铁酸钾的离子方程式:
您最近半年使用:0次



