解题方法
1 . 以二氧化铈(CeO2)为原料制备碳酸铈(Ce2(CO3)3)的工业流程如下:
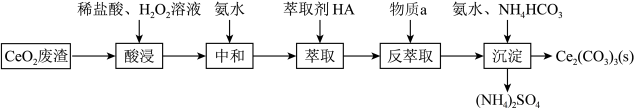
已知水溶液中的Ce3+能被有机萃取剂(HA)萃取,萃取原理可表示为 ;回答下列问题:
;回答下列问题:
(1)写出两条可以提高酸浸效率的措施___________ 、___________ 。
(2)写出酸浸过程中发生反应的离子方程式___________ ,其中H2O2的作用是___________ 。
(3)萃取前加氨水中和的目的是___________ (用平衡移动的原理解释)。
(4)写出物质a的化学式___________ 。
(5)写出沉淀过程的离子方程式___________ 。
(6)该流程中可循环使用的试剂为___________ 。

已知水溶液中的Ce3+能被有机萃取剂(HA)萃取,萃取原理可表示为
 ;回答下列问题:
;回答下列问题:(1)写出两条可以提高酸浸效率的措施
(2)写出酸浸过程中发生反应的离子方程式
(3)萃取前加氨水中和的目的是
(4)写出物质a的化学式
(5)写出沉淀过程的离子方程式
(6)该流程中可循环使用的试剂为
您最近半年使用:0次
23-24高一下·吉林·开学考试
名校
2 . Ⅰ.氯气及其化合物在自来水的消毒,农药的生产、药物的合成等领域都有着重要的应用。
(1)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为________ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为________ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:
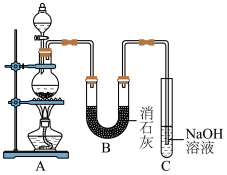
(2)C装置的作用是________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是________ 。
②另一个副反应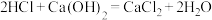 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为________ 。
(1)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(2)C装置的作用是
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应
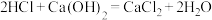 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为
您最近半年使用:0次
解题方法
3 . “太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生H2.如常见的铁氧化物循环制氢过程如图所示。

(1)写出反应Ⅰ的化学方程式:
(2)若该反应生成标准状况下5.6 L氢气,转移电子数目为:
您最近半年使用:0次
解题方法
4 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近半年使用:0次
2024-03-23更新
|
49次组卷
|
2卷引用:湖南省衡阳市衡阳县第四中学2023-2024学年高一上学期10月月考化学试卷
名校
解题方法
5 . 硝酸厂烟气中的大量NO经还原法可转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如下图所示。下列说法中错误的是
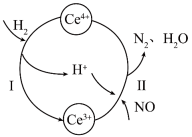

A.反应过程中混合溶液内 和 和 的总数不变 的总数不变 |
B.该转化过程中 为催化剂 为催化剂 |
| C.反应I中氧化剂与还原剂的物质的量之比为1∶2 |
D.反应II的离子反应方程式为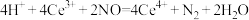 |
您最近半年使用:0次
解题方法
6 . 亚硝酸钠(NaNO2)有毒、有咸味,外形与食盐相似,人若误食会引起中毒。某兴趣小组欲研究亚硝酸钠,查阅资料得到如表信息。试根据信息回答下列问题:
(1)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,则该反应中氧化剂是 _______ ;若有0.75mol电子发生转移,则被氧化的还原剂的粒子数为 _______ (用NA表示阿伏加德罗常数的值)。
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
(3)下列方法中,可用来区分NaNO2和NaCl的是 _______ (填序号)。
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_______ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+。 |
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
| A.NaNO2被还原 |
| B.维生素C具有还原性 |
| C.还原性:维生素C>Fe2+ |
| D.NaNO2是还原剂 |
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近半年使用:0次
2024·北京·模拟预测
名校
解题方法
7 . 分析含有少量NaOH的NaClO溶液与FeSO4溶液的反应。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
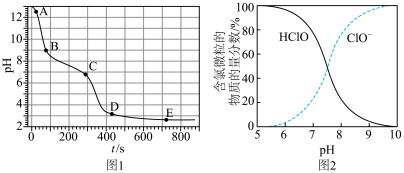
A.A点溶液的pH约为13,主要原因是ClO− + H2O HClO + OH− HClO + OH− |
| B.AB段pH显著下降的原因是5ClO-+2Fe2+ + 5H2O=Cl−+ 2Fe(OH)3↓+ 4HClO |
| C.CD段较BC段pH下降快的主要原因是HClO+2Fe2+ +5H2O=2Fe(OH)3↓+Cl-+ 5H+ |
| D.反应进行至400s时溶液中产生Cl2的原因是:ClO-+ Cl-+2H+=Cl2↑+ H2O |
您最近半年使用:0次
2024-03-19更新
|
341次组卷
|
4卷引用:2023-2024学年度第二学期高三化学零模试卷
(已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题北京市顺义牛栏山第一中学2023-2024学年高二下学期4月月考化学试题2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学
解题方法
8 . 水体中过量氨氮(以NH3表示)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如图所示。下列说法正确的是
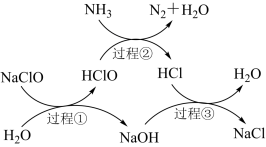

| A.过程①②③均属于氧化还原反应 |
| B.在较高温度下,氨氮去除率会降低 |
| C.每生成一个N2分子,转移6个电子 |
D.过程②中氧化剂与还原剂的物质的量之比是 |
您最近半年使用:0次
解题方法
9 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为__________ 。
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:__________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:
方案一:碱性条件下用 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为__________ 。
方案二:在碱性条件下,用铝粉处理,已知反应时Al与 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是__________ ,还原产物是__________ ,请写出反应的离子方程式:__________ 。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:
(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:方案一:碱性条件下用
 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为方案二:在碱性条件下,用铝粉处理,已知反应时Al与
 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是
您最近半年使用:0次
解题方法
10 . 如图,是工业生产中除去电石渣浆(含CaO)中的 并制取硫酸盐的一种常用流程。下列说法错误的是
并制取硫酸盐的一种常用流程。下列说法错误的是
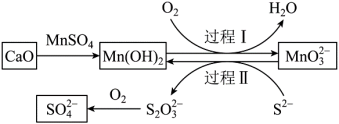
 并制取硫酸盐的一种常用流程。下列说法错误的是
并制取硫酸盐的一种常用流程。下列说法错误的是
A.碱性条件下,氧化性: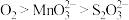 |
| B.过程Ⅰ中氧化剂和还原剂物质的量之比为1∶2 |
C.过程Ⅰ中,反应的离子方程式为 |
D.将1mol  转化为 转化为 理论上需要 理论上需要 的体积为22.4L(标准状况) 的体积为22.4L(标准状况) |
您最近半年使用:0次



