用图所示实验装置可以完成中学化学实验中的一些实验。
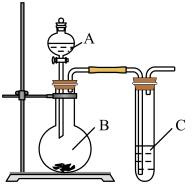
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________ ,A中试剂________ ,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________ 溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________ ,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________ (选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________ 溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________

(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称
②C中发生反应的化学方程式:
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:
更新时间:2020-04-19 11:20:29
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
【推荐1】纳米铁粉可用作隐形材料。一种制备纳米铁粉工艺的实验步骤如下:
①在磁力搅拌作用下,向温度约为80℃的饱和FeSO4溶液中不断加入饱和H2C2O4溶液至不再产生黄色沉淀(FeC2O4·2H2O)为止;
②过滤,用煮沸过的蒸馏水将黄色沉淀洗涤干净;
③干燥固体后,在700℃ 并隔绝空气的条件下将固体焙烧至完全变黑。
(1)步骤①中搅拌的目的是______ ,每生成0.1 mol FeC2O4·2H2O,生成H2SO4的物质的量为_______ mol。
(2)步骤②洗涤用的蒸馏水需预先煮沸的目的是______
(3)步骤③中生成纳米铁的化学方程式为______ 。
(4)在两支三口烧瓶中盛有相同体积、用硫酸酸化的水样,将其中一支烧瓶中的溶液控制在无氧的条件下,然后分别向烧瓶中加入相同量(足量)的纳米铁粉,测得NO 的脱除率与时间的关系如图所示:
的脱除率与时间的关系如图所示:
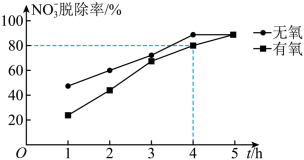
①已知在有氧条件下,起始时水样中c(NO )=1.8 × 10-3mol·L-1,则0~4 h内,v(NO
)=1.8 × 10-3mol·L-1,则0~4 h内,v(NO )=
)=______ mol·L-1·h-1。
②由图可知,3 h前,无氧条件下NO 的脱除率明显比有氧条件下的高,其原因是
的脱除率明显比有氧条件下的高,其原因是______ 。
①在磁力搅拌作用下,向温度约为80℃的饱和FeSO4溶液中不断加入饱和H2C2O4溶液至不再产生黄色沉淀(FeC2O4·2H2O)为止;
②过滤,用煮沸过的蒸馏水将黄色沉淀洗涤干净;
③干燥固体后,在700℃ 并隔绝空气的条件下将固体焙烧至完全变黑。
(1)步骤①中搅拌的目的是
(2)步骤②洗涤用的蒸馏水需预先煮沸的目的是
(3)步骤③中生成纳米铁的化学方程式为
(4)在两支三口烧瓶中盛有相同体积、用硫酸酸化的水样,将其中一支烧瓶中的溶液控制在无氧的条件下,然后分别向烧瓶中加入相同量(足量)的纳米铁粉,测得NO
 的脱除率与时间的关系如图所示:
的脱除率与时间的关系如图所示:
①已知在有氧条件下,起始时水样中c(NO
 )=1.8 × 10-3mol·L-1,则0~4 h内,v(NO
)=1.8 × 10-3mol·L-1,则0~4 h内,v(NO )=
)=②由图可知,3 h前,无氧条件下NO
 的脱除率明显比有氧条件下的高,其原因是
的脱除率明显比有氧条件下的高,其原因是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】钴一种非常稀缺的金属资源,素有“工业味精”和“工业牙齿”之称,是重要的战略资源之一、某工业废料中含稀土元素和少量 、
、 、
、 等金属离子,分离其中的稀土元素后,从萃余液中回收氧化钴的工艺流程如下:
等金属离子,分离其中的稀土元素后,从萃余液中回收氧化钴的工艺流程如下:
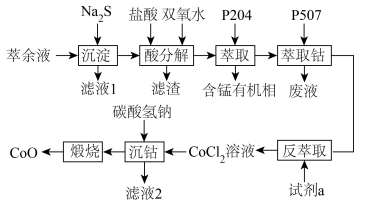
已知25℃时, ,
,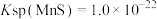 ,
,
萃取钴的原理: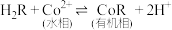
回答下列问题:
(1)钴元素在元素周期表中的位置___________ 。
(2)要使 完全沉淀,
完全沉淀, 至少为
至少为___________ 。
(3)酸分解时控制温度50~60℃,原因是___________ 。
(4)反萃取时最合适的试剂a是___________ 。
(5)写出“沉钴”时发生反应的离子方程式___________ 。
(6)“沉钴”后需将沉淀洗涤干净,实验室检验该沉淀是否洗净的方法是______ 。
(7)“煅烧”必须在氩气中进行,若在空气中煅烧,400℃时会生成另一种钴的氧化物,固体残留率为69.7%,则该反应的化学方程式为___________ 。
 、
、 、
、 等金属离子,分离其中的稀土元素后,从萃余液中回收氧化钴的工艺流程如下:
等金属离子,分离其中的稀土元素后,从萃余液中回收氧化钴的工艺流程如下:
已知25℃时,
 ,
,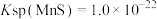 ,
,
萃取钴的原理:
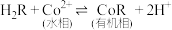
回答下列问题:
(1)钴元素在元素周期表中的位置
(2)要使
 完全沉淀,
完全沉淀, 至少为
至少为(3)酸分解时控制温度50~60℃,原因是
(4)反萃取时最合适的试剂a是
(5)写出“沉钴”时发生反应的离子方程式
(6)“沉钴”后需将沉淀洗涤干净,实验室检验该沉淀是否洗净的方法是
(7)“煅烧”必须在氩气中进行,若在空气中煅烧,400℃时会生成另一种钴的氧化物,固体残留率为69.7%,则该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
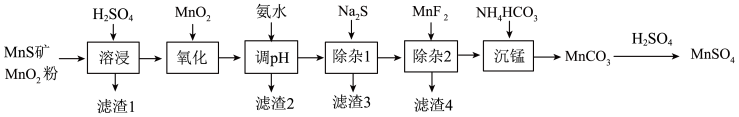
相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
(1)Fe2+的价电子排布式为_______ ,在元素周期表中Zn处于_______ 区。
(2)“滤渣1”含有S和_______ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(3)“氧化”中添加适量的MnO2的作用是_______ 。
(4)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(7)写出“沉锰”的离子方程式_______ 。
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=_______ 。

相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)Fe2+的价电子排布式为
(2)“滤渣1”含有S和
(3)“氧化”中添加适量的MnO2的作用是
(4)“调pH”除铁和铝,溶液的pH范围应调节为
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(7)写出“沉锰”的离子方程式
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】黄铜矿有关转化关系如图所示。
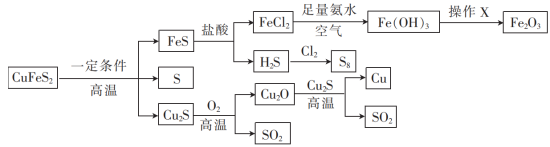
回答下列问题:
(1)尾气 可以制备一种二元强酸,它是
可以制备一种二元强酸,它是_______ (填化学式,下同);也可以制备一种具有还原性的钠盐(正盐),该盐是_______ 。
(2)已知 中的铜、铁元素都是+2价,整个转化关系中,发生了氧化还原反应的反应有
中的铜、铁元素都是+2价,整个转化关系中,发生了氧化还原反应的反应有_______ 个。
(3)在实验室完成操作X,宜选择的仪器有_______ (填标号)。

(4) 与
与 在高温下反应的化学方程式为
在高温下反应的化学方程式为_______ 。
(5)在上述转化中,能证明氯的非金属性比硫强的化学方程式为_______ 。
(6)某黄铜矿(主要成分是 ,含少量
,含少量 )中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得
)中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得_______  。
。

回答下列问题:
(1)尾气
 可以制备一种二元强酸,它是
可以制备一种二元强酸,它是(2)已知
 中的铜、铁元素都是+2价,整个转化关系中,发生了氧化还原反应的反应有
中的铜、铁元素都是+2价,整个转化关系中,发生了氧化还原反应的反应有(3)在实验室完成操作X,宜选择的仪器有

(4)
 与
与 在高温下反应的化学方程式为
在高温下反应的化学方程式为(5)在上述转化中,能证明氯的非金属性比硫强的化学方程式为
(6)某黄铜矿(主要成分是
 ,含少量
,含少量 )中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得
)中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得 。
。
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】以高硫铝土矿(主要成分为 、
、 、少量
、少量 和金属硫酸盐)为原料,生产氧化铝并获得
和金属硫酸盐)为原料,生产氧化铝并获得 的部分工艺流程如图所示,
的部分工艺流程如图所示, 能溶于NaOH溶液,
能溶于NaOH溶液, 与NaOH溶液不反应。
与NaOH溶液不反应。
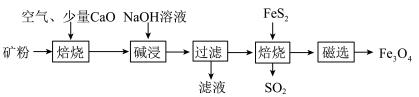
(1)焙烧过程均会产生 ,用NaOH溶液吸收过量
,用NaOH溶液吸收过量 的离子方程式为
的离子方程式为_____________________ 。
(2)添加1% 和不添加
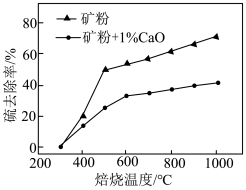
和不添加 的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
已知:多数金属硫酸盐的分解温度都高于 ;
;
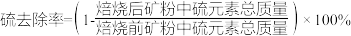 。
。
①不添加CaO的矿粉在低于 焙烧时,去除的硫元素主要来源于
焙烧时,去除的硫元素主要来源于____________ (填化学式)。
②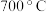 焙烧时,添加1%
焙烧时,添加1% 的矿粉硫去除率比不添加
的矿粉硫去除率比不添加 的矿粉硫去除率低,其主要原因是
的矿粉硫去除率低,其主要原因是_________________________ 。
 、
、 、少量
、少量 和金属硫酸盐)为原料,生产氧化铝并获得
和金属硫酸盐)为原料,生产氧化铝并获得 的部分工艺流程如图所示,
的部分工艺流程如图所示, 能溶于NaOH溶液,
能溶于NaOH溶液, 与NaOH溶液不反应。
与NaOH溶液不反应。
(1)焙烧过程均会产生
 ,用NaOH溶液吸收过量
,用NaOH溶液吸收过量 的离子方程式为
的离子方程式为(2)添加1%
 和不添加
和不添加 的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
已知:多数金属硫酸盐的分解温度都高于
 ;
;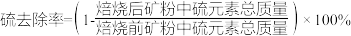 。
。①不添加CaO的矿粉在低于
 焙烧时,去除的硫元素主要来源于
焙烧时,去除的硫元素主要来源于②
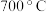 焙烧时,添加1%
焙烧时,添加1% 的矿粉硫去除率比不添加
的矿粉硫去除率比不添加 的矿粉硫去除率低,其主要原因是
的矿粉硫去除率低,其主要原因是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】铜与浓硫酸在如图所示装置中发生反应,实验中观察到的现象为A试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀。试回答下列问题:_______ 。
(2)B试管现象是______ ,实验完毕后取对B溶液加热,可观察到的现象是_____ 。
(3)湿碱棉团的作用是______ ,反应的离子方程式为________ 。
(4)浓硫酸与木炭在加热条件下可发生化学反应则反应方程式为_______ 。
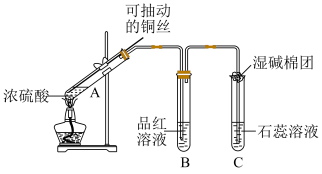
(2)B试管现象是
(3)湿碱棉团的作用是
(4)浓硫酸与木炭在加热条件下可发生化学反应则反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。

(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是____ (用化学方程式表示)。
(2)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。
请回答:
①B中反应的离子方程式是____ 。
②C装置的作用是____ ,X是____ 。
③为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是____ ,装置D中反应的化学方程是____ 。

(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是
(2)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。
请回答:
①B中反应的离子方程式是
②C装置的作用是
③为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
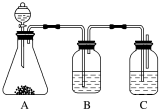
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为_______ 。
(2)装置B所盛的试剂是_______ 。
(3)装置 C中反应的离子方程式是_______ 。
(4)由此得到的结论是酸性:_______ >_______ >_______ 。

(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为
(2)装置B所盛的试剂是
(3)装置 C中反应的离子方程式是
(4)由此得到的结论是酸性:
您最近一年使用:0次




