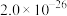二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
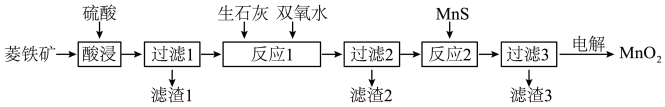
(1)酸浸过程中,MnCO3溶解的离子方程式为______ ,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________ 。
(2)滤渣3的主要成分是________ ,除铁的过程中,应该先加________ (填“生石灰”或“双氧水”),原因是__________ 。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________ 。

(1)酸浸过程中,MnCO3溶解的离子方程式为
(2)滤渣3的主要成分是
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:
更新时间:2020-05-14 19:08:28
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】金属回收与利用有利于环境保护。以某废渣(主要含Cd,还含少量Zn、Cu、Fe、Co等单质)为原料回收Cd,工艺流程如图所示:

已知几种金属离子沉淀的pH如表所示。
请回答下列问题:
(1)“酸浸”中加入稀硫酸,充分反应后过滤得到滤渣1的主要成分是_______ (填化学式)。
(2)“除钴”时,向含Co2+的浸液中加入Zn和Sb2O3,恰好产生CoSb合金,写出该反应的离子方程式:_______ 。若将该反应设计成原电池,锌在_______ 极发生反应。
(3)“除铁”时,先加入KMnO4氧化Fe2+ ,后加ZnO调溶液pH。加入ZnO调节溶液pH的范围为_______ 。 过滤,得滤渣2为MnO2和_______ (填化学式)。
(4)“电解”过程中以石墨为电极得到粗镉的电解总反应的化学方程式为_______ 。
(5)已知:常温下,Ksp[Cd(OH)2]≈2.0×10-16.如果用生石灰处理含Cd2+的电解废液,当pH=10时,c(Cd2+)=_______ mol/L。

已知几种金属离子沉淀的pH如表所示。
| 离子 | Fe3+ | Fe2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 完全沉淀的pH | 3.3 | 9.9 | ? |
请回答下列问题:
(1)“酸浸”中加入稀硫酸,充分反应后过滤得到滤渣1的主要成分是
(2)“除钴”时,向含Co2+的浸液中加入Zn和Sb2O3,恰好产生CoSb合金,写出该反应的离子方程式:
(3)“除铁”时,先加入KMnO4氧化Fe2+ ,后加ZnO调溶液pH。加入ZnO调节溶液pH的范围为
(4)“电解”过程中以石墨为电极得到粗镉的电解总反应的化学方程式为
(5)已知:常温下,Ksp[Cd(OH)2]≈2.0×10-16.如果用生石灰处理含Cd2+的电解废液,当pH=10时,c(Cd2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。如图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和Fe2O3)制备活性氧化锌的工艺流程:
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。

(1)操作a名称是__ ,在实验室中,该操作用到的主要玻璃仪器有___ 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:①__ ;②__ ;③调节溶液的pH(控制其在5.0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是__ ;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方程式:__ 。
(5)操作b是__ ;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3•bZn(OH)2•cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行了实验:称取3.59g沉淀进行焙烧,直到焙烧到所得固体质量不再变化为止,还需要至少测两种物质的质量,这两种物质可以是__ 。
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。

(1)操作a名称是
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:①
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方程式:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
(5)操作b是
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3•bZn(OH)2•cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行了实验:称取3.59g沉淀进行焙烧,直到焙烧到所得固体质量不再变化为止,还需要至少测两种物质的质量,这两种物质可以是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】一种利用某镍矿资源(主要成分为 、
、 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 )提取含Ni、Cu、Fe、Mg、Al的物质的流程如下:
)提取含Ni、Cu、Fe、Mg、Al的物质的流程如下:
i.25℃时,一些物质的 如下:
如下:
ii.溶液中离子浓度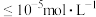 时认为该离子沉淀完全。
时认为该离子沉淀完全。
(1)流程中能加快反应速率的措施有_________ 。
(2)固体A中还有少量酸浸后剩余的NiS,II中反应的离子方程式为_________ 。
(3)III中,生成 转移
转移 ,III中反应的化学方程式为
,III中反应的化学方程式为_________ ;III过滤后得到的固体残渣中含有的物质是_________ 。
(4)IV可以除去溶液D中的 ,由此推测氧化性
,由此推测氧化性
_________  (填“>”或“<”)。
(填“>”或“<”)。
(5)结合离子方程式解释V中加入 的作用:
的作用:_________ 。
(6)为了使 沉淀完全,VI中溶液pH的最小值所属范围为
沉淀完全,VI中溶液pH的最小值所属范围为_________ (填字母)。
a.2~3 b.3~4 c.9~10 d.10~11
(7)VI中, 不宜多加,原因是
不宜多加,原因是_________ 。
 、
、 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 )提取含Ni、Cu、Fe、Mg、Al的物质的流程如下:
)提取含Ni、Cu、Fe、Mg、Al的物质的流程如下: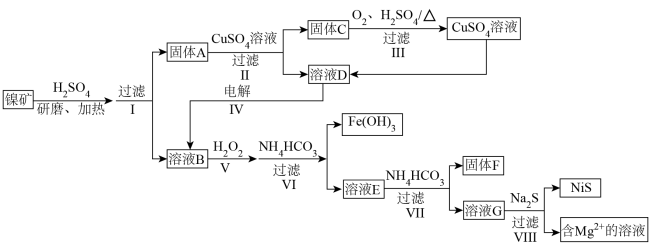
i.25℃时,一些物质的
 如下:
如下:物质 |
|
|
|
|
|
|
|
|
|
|
|
|
|
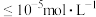 时认为该离子沉淀完全。
时认为该离子沉淀完全。(1)流程中能加快反应速率的措施有
(2)固体A中还有少量酸浸后剩余的NiS,II中反应的离子方程式为
(3)III中,生成
 转移
转移 ,III中反应的化学方程式为
,III中反应的化学方程式为(4)IV可以除去溶液D中的
 ,由此推测氧化性
,由此推测氧化性
 (填“>”或“<”)。
(填“>”或“<”)。(5)结合离子方程式解释V中加入
 的作用:
的作用:(6)为了使
 沉淀完全,VI中溶液pH的最小值所属范围为
沉淀完全,VI中溶液pH的最小值所属范围为a.2~3 b.3~4 c.9~10 d.10~11
(7)VI中,
 不宜多加,原因是
不宜多加,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
回答下列问题:
(1)甲装置中仪器A的名称为_____ 。
(2)用甲装置制氯气,MnO 被还原为Mn2+,该反应的离子方程式为
被还原为Mn2+,该反应的离子方程式为 _____ 。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_____ (填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应; ②_____ 。
(4)如果缺少乙装置,可能发生的副反应的化学方程式为_____ ;己装置的作用是 _____ :
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有 (填标号)。
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38gSnCl4,则SnCl4的产率为 _____ 。(保留3位有效数字)

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | ﹣33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
(1)甲装置中仪器A的名称为
(2)用甲装置制氯气,MnO
 被还原为Mn2+,该反应的离子方程式为
被还原为Mn2+,该反应的离子方程式为 (3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到
(4)如果缺少乙装置,可能发生的副反应的化学方程式为
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有 (填标号)。
| A.H2O2溶液 |
| B.FeCl3溶液(滴有KSCN) |
| C.AgNO3溶液 |
| D.溴水 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
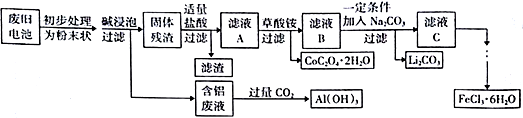
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是(写两点)_______________ 。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________ 。
(3)滤液A中的溶质除HCl、LiCl外还有__________ (填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________ 。
(4)滤渣的主要成分为____________________ (填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________ mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________ 。

已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是(写两点)
(2)从含铝废液得到Al(OH)3的离子反应方程式为
(3)滤液A中的溶质除HCl、LiCl外还有
(4)滤渣的主要成分为
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| Ⅰ | 120-220 | CoC2O4·2H2O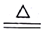 CoC2O4+2H2O CoC2O4+2H2O | 19.67% |
| Ⅱ | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________ 。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________ 。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______ 。
(4)反应Ⅲ中X可以是______ 。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×10−7,K2=7.0×10−15。0.1 mol/L NaHS的pH___ 7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L−1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=________ 。[已知:Ksp(MnS)=1.4×10−15]

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式
(4)反应Ⅲ中X可以是
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×10−7,K2=7.0×10−15。0.1 mol/L NaHS的pH
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L−1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】回答下列问题
Ⅰ.ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如图:

已知:
①锆英石能与烧碱高温反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如表:
(1)锆英石碱熔时需要粉碎,其目的是_______ 。
(2)ZrSiO4中Zr的化合价为_______ 。a的取值范围为:_______ ,滤渣2的主要成分为_______ 。
(3)“碱熔”过程中ZrSiO4发生反应的化学方程式_______ 。
(4)本流程使用NaCN除铜,若盐酸溶解后溶液中c(Cu2+)=0.01mol∙L-1,当溶液中Cu2+开始沉淀时,c(CN-)=_______ 。(已知Ksp[Cu(CN)2]=4×10-10)
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(5)已知阴极室溶液呈酸性,则阴极的电极反应式为_______ 。反应过程中通过质子交换膜的 为2mol时,吸收塔中生成的气体在标准状况下的体积为
为2mol时,吸收塔中生成的气体在标准状况下的体积为_______ L。
Ⅰ.ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如图:

已知:
①锆英石能与烧碱高温反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如表:
| 离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 完全沉淀时pH | 3.2 | 5.2 | 8.0 |
(1)锆英石碱熔时需要粉碎,其目的是
(2)ZrSiO4中Zr的化合价为
(3)“碱熔”过程中ZrSiO4发生反应的化学方程式
(4)本流程使用NaCN除铜,若盐酸溶解后溶液中c(Cu2+)=0.01mol∙L-1,当溶液中Cu2+开始沉淀时,c(CN-)=
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(5)已知阴极室溶液呈酸性,则阴极的电极反应式为
 为2mol时,吸收塔中生成的气体在标准状况下的体积为
为2mol时,吸收塔中生成的气体在标准状况下的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室用如图装置制备 (省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含
(省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含 3.0g的
3.0g的 溶液和一定量活性炭,边通氨气边缓慢滴加
溶液和一定量活性炭,边通氨气边缓慢滴加 溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
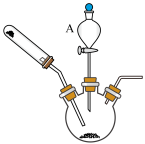
(1)仪器A的名称为___________ ;控制温度的方法为__________ ;尾气吸收装置最合适的为__________ (从图中选择)。

(2)反应中活性炭的作用是___________ 。
a.脱色剂 b.氧化剂 c.还原剂 d.催化剂
(3)操作a的名称为___________ ;加浓氨水的目的为__________________ 。
(4)制备 总反应的化学方程式为
总反应的化学方程式为________________ ,计算本实验的产率_________ (保留3位有效数字)。
 (省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含
(省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含 3.0g的
3.0g的 溶液和一定量活性炭,边通氨气边缓慢滴加
溶液和一定量活性炭,边通氨气边缓慢滴加 溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
物质 | 颜色 | 溶解性 | 相对分子质量 |
| 粉红 | 溶于水、盐酸、氨水等 | 238 |
| 橙黄 | 溶于热水、盐酸,难溶于乙醇、氨水 | 267.5 |

(2)反应中活性炭的作用是
a.脱色剂 b.氧化剂 c.还原剂 d.催化剂
(3)操作a的名称为
(4)制备
 总反应的化学方程式为
总反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】硫代硫酸钠 (Na2S2O3)可用作分析试剂及还原剂,遇酸易分解。
Ⅰ.某化工厂生产硫代硫酸钠的流程如下:
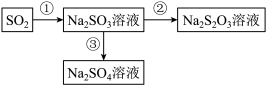
(1)为实现反应②,从氧化还原的角度分析,下列转化关系中正确的是_______(填序号)。
(2)反应①制备的 溶液易发生反应③而变质,证明
溶液易发生反应③而变质,证明 已变质的试剂为
已变质的试剂为_______ (填名称)。
Ⅱ.某学习小组利用绿矾 ( )分解生成的
)分解生成的 气体制备硫代硫酸钠,装置如图所示。
气体制备硫代硫酸钠,装置如图所示。
已知:①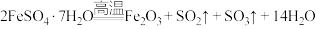
② 的沸点为
的沸点为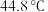 、熔点为
、熔点为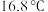 ,
, 的沸点为
的沸点为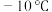 。
。
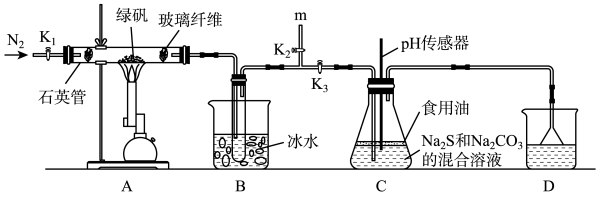
检查装置气密性后加入药品,依次进行如下操作:
①打开活塞 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 ;
;
②关闭活塞 、
、 ,打开活塞
,打开活塞 ,加热绿矾;
,加热绿矾;
③装置C中的混合溶液 约为8时停止加热;
约为8时停止加热;
④在m处连接盛有 溶液的容器,关闭活塞
溶液的容器,关闭活塞 ,_______;
,_______;
⑤从锥形瓶中得到 晶体。
晶体。
回答下列问题:
(3)补充完善步骤④_______ 。
(4)装置B中使用冰水浴的目的是_______ 。
(5)装置D中盛放的溶液可以是_______ (填序号)。
A. 溶液 B.稀氨水 C.稀
溶液 B.稀氨水 C.稀
(6)写出装置C中制备 的化学方程式
的化学方程式_______ 。
Ⅰ.某化工厂生产硫代硫酸钠的流程如下:

(1)为实现反应②,从氧化还原的角度分析,下列转化关系中正确的是_______(填序号)。
A. | B. |
C.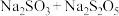 | D. |
 溶液易发生反应③而变质,证明
溶液易发生反应③而变质,证明 已变质的试剂为
已变质的试剂为Ⅱ.某学习小组利用绿矾 (
 )分解生成的
)分解生成的 气体制备硫代硫酸钠,装置如图所示。
气体制备硫代硫酸钠,装置如图所示。已知:①
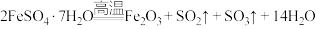
②
 的沸点为
的沸点为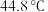 、熔点为
、熔点为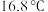 ,
, 的沸点为
的沸点为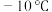 。
。
检查装置气密性后加入药品,依次进行如下操作:
①打开活塞
 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 ;
;②关闭活塞
 、
、 ,打开活塞
,打开活塞 ,加热绿矾;
,加热绿矾;③装置C中的混合溶液
 约为8时停止加热;
约为8时停止加热;④在m处连接盛有
 溶液的容器,关闭活塞
溶液的容器,关闭活塞 ,_______;
,_______;⑤从锥形瓶中得到
 晶体。
晶体。回答下列问题:
(3)补充完善步骤④
(4)装置B中使用冰水浴的目的是
(5)装置D中盛放的溶液可以是
A.
 溶液 B.稀氨水 C.稀
溶液 B.稀氨水 C.稀
(6)写出装置C中制备
 的化学方程式
的化学方程式
您最近一年使用:0次