A、B、D、E、F、G六种元素的原子序数依次增大,除F、G为第四周期过渡元素外,其余四种均是短周期元素。已知:F的单质为生活中最常见的金属之一,原子最外层有2个电子;E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;A、D原子p轨道的电子数分别为2和4;G基态原子的最外层电子半充满,内层全充满。请回答下列问题:
(1)F的稳定价态离子的电子排布式是___ ,A、B、D、E四种元素的第一电离能由大到小的顺序为__ (用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是___ ,分子的立体构型为___ ,该氢化物易溶于D的简单氢化物的主要原因是___ 。
(3)D原子分别与A、B原子形成的单键中,键的极性较强的是___ (用具体的化学键表示)。
(4)如图所示的晶胞是由A、D两元素组成的,下列有关该晶体的说法中正确的是__ 。

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
(5)G的硫酸盐溶液滴加少量氨水的离子方程式为___ ,继续滴加过量氨水的离子方程式为___ ,再加一定体积乙醇溶液析出深蓝色晶体的化学式为___ ,该晶体中包含的化学键有___ 。
(1)F的稳定价态离子的电子排布式是
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是
(3)D原子分别与A、B原子形成的单键中,键的极性较强的是
(4)如图所示的晶胞是由A、D两元素组成的,下列有关该晶体的说法中正确的是

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
(5)G的硫酸盐溶液滴加少量氨水的离子方程式为
更新时间:2020-05-27 20:47:09
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高。请回答下列问题:
(1)W原子L层电子排布式为__________________ W3空间构形是__________________
(2)X单质与水反应的主要化学方程式______________________
(3)化合物M的化学式______________ 其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是__________________________ 。将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有____________________ ,O-C-O的键角约__________
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=_________________ 。
(5)含有元素Z的盐的焰色反应为________ 色,许多金属盐都可以发生焰色反应,其原因是___________________________________________
(6) ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________________________________________ g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为____________ pm。

(1)W原子L层电子排布式为
(2)X单质与水反应的主要化学方程式
(3)化合物M的化学式
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=
(5)含有元素Z的盐的焰色反应为
(6) ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】卤族元素可以与很多元素形成多种具有不同组成、结构、性质的物质。请回答下列问题:
(1) (键角为180°)的中心I原子价层电子对数为
(键角为180°)的中心I原子价层电子对数为___________ ;
___________ (填“是”或“否”)具有极性;基态碘原子价电子排布式为___________ 。
(2)物质磁性大小以磁矩μ表示,μ与未成对电子数之间的关系为: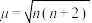 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的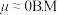 (B.M磁矩单位),
(B.M磁矩单位), 的杂化类型为
的杂化类型为___________ 。
a.sp3 b.dsp2 c.d2sp3
配合物 中配离子
中配离子 的
的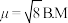 ,则配离子的空间构型为
,则配离子的空间构型为___________ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。___________ 。
(4)在极高压强下,氯化钠可以和氯气化合生成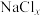 。
。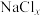 是立方系晶胞,结构如图3所示,其中两个氯原子的坐标为(0.00,0.50,0.15)、(0.00,0.50,0.85),晶体的化学式为
是立方系晶胞,结构如图3所示,其中两个氯原子的坐标为(0.00,0.50,0.15)、(0.00,0.50,0.85),晶体的化学式为___________ ;与Na距离最近的且相等的Cl有___________ 个。
(1)
 (键角为180°)的中心I原子价层电子对数为
(键角为180°)的中心I原子价层电子对数为
(2)物质磁性大小以磁矩μ表示,μ与未成对电子数之间的关系为:
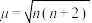 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的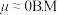 (B.M磁矩单位),
(B.M磁矩单位), 的杂化类型为
的杂化类型为a.sp3 b.dsp2 c.d2sp3
配合物
 中配离子
中配离子 的
的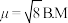 ,则配离子的空间构型为
,则配离子的空间构型为(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。

(4)在极高压强下,氯化钠可以和氯气化合生成
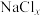 。
。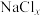 是立方系晶胞,结构如图3所示,其中两个氯原子的坐标为(0.00,0.50,0.15)、(0.00,0.50,0.85),晶体的化学式为
是立方系晶胞,结构如图3所示,其中两个氯原子的坐标为(0.00,0.50,0.15)、(0.00,0.50,0.85),晶体的化学式为
您最近一年使用:0次
【推荐3】乙醇能使酸性高锰酸钾溶液褪色,发生反应:5C2H5OH+4MnO4-+ 12H++13H2O=5CH3COOH+4[Mn(H2O)6]2+。
(1)H、C、O中.原子半轻最大的是______ (填元素符号,下同).电负性最大的是___________ 。
(2)[Mn(H2O)6]2+中Mn- O化学键称为_______ 键,其电子对________ 由提供。 H2O与H+结合生成H3O+ ,与H3O+所含原子总数相等的等电子体是________ (填分子式,写一种)。
(3)在上述反应中C2H5OH转化为CH3COOH,C原子的杂化轨道类型由____ 变为________ 。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为____________ 。
(5)第一电离能I1(O)___ (填”>”“<”或”=“)I1(S),其原因是___________________ 。
(6)β- MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。若距离最近的两个锰原子之间的距离为b pm,阿伏加德罗常数的值为NA.则β- MnSe的密度 =
=____ (列出表达式)g· cm-3。

(1)H、C、O中.原子半轻最大的是
(2)[Mn(H2O)6]2+中Mn- O化学键称为
(3)在上述反应中C2H5OH转化为CH3COOH,C原子的杂化轨道类型由
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为
(5)第一电离能I1(O)
(6)β- MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。若距离最近的两个锰原子之间的距离为b pm,阿伏加德罗常数的值为NA.则β- MnSe的密度
 =
=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
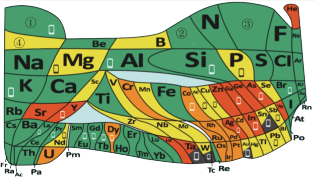
【推荐1】化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成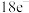 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与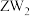 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 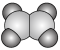 b.
b.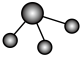 c.
c. 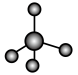 d.
d.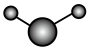
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
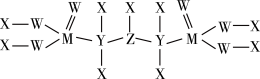
 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖相同。
(1)M位于元素名称为________ ;
(2)X、Y、Z元素原子半径最大的是__________ (填元素符号);
(3)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝色的气体,p的化学式为_______________ 。
(4)(XY)2的性质与氯气相似,常温下(XY)2与NaOH溶液反应的离子方程式为_______________________________________ ;
(5)常温下, 1mol Z3能与Y的最近简单氢化物反应,生成一种常见的盐和1mol Z2,该反应的化学方程式为_______________________________________ 。
(1)M位于元素名称为
(2)X、Y、Z元素原子半径最大的是
(3)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝色的气体,p的化学式为
(4)(XY)2的性质与氯气相似,常温下(XY)2与NaOH溶液反应的离子方程式为
(5)常温下, 1mol Z3能与Y的最近简单氢化物反应,生成一种常见的盐和1mol Z2,该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、X、Y、Z是l~36号原元素中,原子序数依次递增的5种元素,其原子结构或元素性质如下:
(1)A元素在周期表中的位置为_______
(2)上述5种元素中:
①原子半径最大的是_______ (填元素符号,下同)。
②电负性最大的是_______ 。
③位于周期表p区的元素有_______ 。
④从原子结构的角度解释元素B的第一电离能高于同周期相邻元素的原因_______ 。
(3)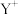 可与某种冠醚形成具有特定结构和功能的聚集体,如右图所示。
可与某种冠醚形成具有特定结构和功能的聚集体,如右图所示。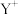 与冠醚之间的作用力属于
与冠醚之间的作用力属于_______ (填字母)。
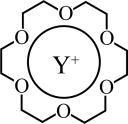
a.离子键 b.配位键 c.氢键 d.范德华力
(4)A、B形成的 常做配位化合物的配体。
常做配位化合物的配体。
①在 中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为
中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为_______ 。
②Z元素与金元素(Au)均能与 形成配离子。已知,
形成配离子。已知,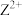 与
与 形成配离子时,配位数为4;
形成配离子时,配位数为4;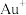 与
与 形成配离子时,配位数为2,工业常用
形成配离子时,配位数为2,工业常用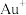 与
与 形成配离子与Z单质反应,生成
形成配离子与Z单质反应,生成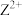 与
与 形成配离子和Au单质来提取Au,写出上述反应的离子方程式:
形成配离子和Au单质来提取Au,写出上述反应的离子方程式:_______ 。
| 元素 | 元素性质或原子结构 |
| A | 基态原子价层电子排布式为 |
| B | 基态原子2p能级有3个单电子 |
| X | 原子最外层电子数是其内层电子数的3倍 |
| Y | 单质与水剧烈反应,发出紫色火焰 |
| Z | 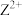 的3d轨道中有10个电子 的3d轨道中有10个电子 |
(2)上述5种元素中:
①原子半径最大的是
②电负性最大的是
③位于周期表p区的元素有
④从原子结构的角度解释元素B的第一电离能高于同周期相邻元素的原因
(3)
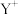 可与某种冠醚形成具有特定结构和功能的聚集体,如右图所示。
可与某种冠醚形成具有特定结构和功能的聚集体,如右图所示。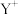 与冠醚之间的作用力属于
与冠醚之间的作用力属于
a.离子键 b.配位键 c.氢键 d.范德华力
(4)A、B形成的
 常做配位化合物的配体。
常做配位化合物的配体。①在
 中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为
中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为②Z元素与金元素(Au)均能与
 形成配离子。已知,
形成配离子。已知,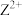 与
与 形成配离子时,配位数为4;
形成配离子时,配位数为4;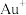 与
与 形成配离子时,配位数为2,工业常用
形成配离子时,配位数为2,工业常用 与
与 形成配离子与Z单质反应,生成
形成配离子与Z单质反应,生成 与
与 形成配离子和Au单质来提取Au,写出上述反应的离子方程式:
形成配离子和Au单质来提取Au,写出上述反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】按照要求回答下列问题。
(1)基态Cu原子的电子排布式为_______ 。
(2)在基态13N原子中,核外存在_______ 对自旋相反的电子。
(3)NH3BH3分子中,与N原子相连的H原子呈正电性(Hδ+),与B原子相连的H原子呈负电性(Hδ-),电负性由小到大的顺序为_______ 。
(4)等浓度、等体积的醋酸和氢氧化钠混合后,溶液中离子浓度大小顺序为_______ 。
(5)已知常温下H2C2O4的电离平衡常数Ka1=5.4×10-2,Ka2=5.4×10-5,反应NH3·H2O+HC2O
 NH
NH +C2O
+C2O +H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=
+H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=_______ 。
(6)已知钼酸钠溶液中c(MoO )=0.40 mol/L,c(CO
)=0.40 mol/L,c(CO )=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO
)=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO ,当BaMoO4开始沉淀时,CO
,当BaMoO4开始沉淀时,CO 的去除率是
的去除率是_______ 【已知Ksp(BaCO3)=1.0×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化】。
(1)基态Cu原子的电子排布式为
(2)在基态13N原子中,核外存在
(3)NH3BH3分子中,与N原子相连的H原子呈正电性(Hδ+),与B原子相连的H原子呈负电性(Hδ-),电负性由小到大的顺序为
(4)等浓度、等体积的醋酸和氢氧化钠混合后,溶液中离子浓度大小顺序为
(5)已知常温下H2C2O4的电离平衡常数Ka1=5.4×10-2,Ka2=5.4×10-5,反应NH3·H2O+HC2O

 NH
NH +C2O
+C2O +H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=
+H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=(6)已知钼酸钠溶液中c(MoO
 )=0.40 mol/L,c(CO
)=0.40 mol/L,c(CO )=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO
)=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO ,当BaMoO4开始沉淀时,CO
,当BaMoO4开始沉淀时,CO 的去除率是
的去除率是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】碳酸二甲酯( )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
ii. 2Cu(OCH3)Cl + CO = (CH3O)2CO + 2CuCl
(1)碳酸二甲酯分子中羰基碳原子的杂化类型是
(2)CuCl中,基态Cu+的价电子排布式为
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受Cu(Ⅰ)(+1价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度较小,且其中的Cu+易被氧化为难溶的CuO。
ⅲ.加入4-甲基咪唑( )可与Cu+形成配合物,可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物,可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
①4-甲基咪唑中,1~4号N原子
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是
a.Cu(Ⅰ)配合物中的-NH结构可增大其在甲醇中的溶解度
b.形成的Cu(Ⅰ)配合物能增大反应的限度
(4)配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是
(5)CaTiO3的晶胞如图(a)所示,金属离子与氧离子间的作用力为
 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐3】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____ 。
(2)B元素的电负性_____ (填“大于”“小于”或“等于”)C元素的电负性。
(3)下列关于F原子的价层电子轨道表示式正确的是_____ (填字母)。
(4)基态F3+的核外电子排布式为______ 。
(5)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是______ 。
(6)B原子核外有______ 种不同运动状态的电子。基态B原子中,能量最高的电子所占据的原子轨道的形状为_____ 。
(7)As的卤化物的熔点如表:
表中卤化物熔点差异的原因是______ 。
(8)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是______ ,Fe3+的配位数为______ 。

| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ·mol-1;I2=1451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(2)B元素的电负性
(3)下列关于F原子的价层电子轨道表示式正确的是
A.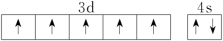 | B.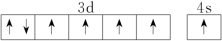 |
C. | D.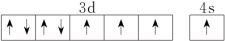 |
(5)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是
(6)B原子核外有
(7)As的卤化物的熔点如表:
| 物质 | AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
(8)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】下图是元素周期表的一部分:
 阴影部分元素的外围电子排布式的通式为
阴影部分元素的外围电子排布式的通式为____ 。Sb的元素名称为____ 。基态P原子中,电子占据的最高能级符号为____ ,该能层具有的原子轨道数为____ 。
 氮族元素氢化物
氮族元素氢化物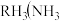 、
、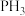 、
、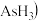 的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物
的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物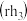 性质可能有
性质可能有____ 。

A.稳定性
B.沸点
C. 键能
键能
D.分子间作用力
 某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有
某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____ 种。

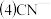 和
和 、
、 及
及 能形成一种蓝色配位化合物普鲁士蓝。如图是该物质的结构单元
能形成一种蓝色配位化合物普鲁士蓝。如图是该物质的结构单元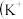 未标出
未标出 ,该图是普鲁士蓝的晶胞吗?
,该图是普鲁士蓝的晶胞吗?____  填“是”或“不是”
填“是”或“不是” ,平均每个结构单元中含有
,平均每个结构单元中含有____ 个 。
。

 磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是
磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是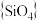 四面体,多磷酸盐中是
四面体,多磷酸盐中是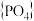 四面体。下图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为
四面体。下图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为____ 。

| C | N | O | F | ||
| Si | P | S | Cl | ||
| Ge | As | Se | Br | ||
| Sn | Sb | Te | I | ||
| Pb | Bi | Po | At | ||
 阴影部分元素的外围电子排布式的通式为
阴影部分元素的外围电子排布式的通式为 氮族元素氢化物
氮族元素氢化物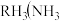 、
、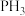 、
、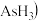 的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物
的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物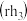 性质可能有
性质可能有
A.稳定性
B.沸点
C.
 键能
键能D.分子间作用力
 某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有
某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有
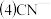 和
和 、
、 及
及 能形成一种蓝色配位化合物普鲁士蓝。如图是该物质的结构单元
能形成一种蓝色配位化合物普鲁士蓝。如图是该物质的结构单元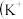 未标出
未标出 ,该图是普鲁士蓝的晶胞吗?
,该图是普鲁士蓝的晶胞吗? 填“是”或“不是”
填“是”或“不是” ,平均每个结构单元中含有
,平均每个结构单元中含有 。
。 
 磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是
磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是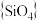 四面体,多磷酸盐中是
四面体,多磷酸盐中是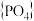 四面体。下图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为
四面体。下图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】I.如图所示为 、金属铜两种晶体的结构示意图。请回答下列问题:
、金属铜两种晶体的结构示意图。请回答下列问题: 晶体中与
晶体中与 最近且等距离的
最近且等距离的 数为
数为___________ ,图1中每个铜原子周围紧邻的铜原子数为___________ 。
(2)金属铜具有很好的延展性、导电性、导热性,对此现象最简单的解释是___________ 理论。
II.中国科学院物理研究所合成了基于铁基超导体系掺杂调控的新型稀磁半导体LiZnqMnpAs(图4),该材料是LiZnAs晶体(如图3所示立方晶胞)中部分Zn原子被Mn原子代替后制成的。已知a点原子的分数坐标为(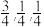 ),图3晶体的密度为dg·cm-3,晶胞参数为cpm。
),图3晶体的密度为dg·cm-3,晶胞参数为cpm。___________ 。
(4)图2晶胞结构中的As___________ (填:“是”、“否”)位于Zn、Mn形成的正四面体空隙中。
(5)阿伏加德罗常数NA=___________ 。
 、金属铜两种晶体的结构示意图。请回答下列问题:
、金属铜两种晶体的结构示意图。请回答下列问题:
 晶体中与
晶体中与 最近且等距离的
最近且等距离的 数为
数为(2)金属铜具有很好的延展性、导电性、导热性,对此现象最简单的解释是
II.中国科学院物理研究所合成了基于铁基超导体系掺杂调控的新型稀磁半导体LiZnqMnpAs(图4),该材料是LiZnAs晶体(如图3所示立方晶胞)中部分Zn原子被Mn原子代替后制成的。已知a点原子的分数坐标为(
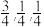 ),图3晶体的密度为dg·cm-3,晶胞参数为cpm。
),图3晶体的密度为dg·cm-3,晶胞参数为cpm。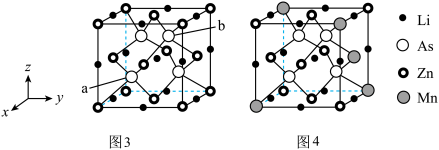
(4)图2晶胞结构中的As
(5)阿伏加德罗常数NA=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】“嫦娥五号“月球探测器成功着陆后,首先打开太阳翼,来提供在月球上工作所需要的能量。太阳翼使用第三代太阳能电池板,除硅外,还有铜、砷镓、硒等元素。请回答下列问题:
(1)基态Cu原子的价电子排布式为_______ ,SeO3分子的立体构型为_______
(2)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是_______ (用氢化物分子式表示),并说明原因_______ 。
(3)Ga、As、Se三种元素第一电离能由大到小的顺序是_______ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700°C下反应制得,反应的方程式为_______ ;已知( CH3)3Ga为非极性分子,则其中镓原子的杂化方式为_______ 。
(5)锌与铜位于同一周期。Zn2+的结构如图印所示,Zn2+的配位数是_______ ;某含铜化合物的晶胞如图乙所示,晶胞上下底面为正方形,便面与底面垂直,则该化合物的化学式是_______ ,设NA为阿伏加德罗常数的值,则该晶胞的密度_______ g·cm-3(用含a、b 、NA的代数式表示)。
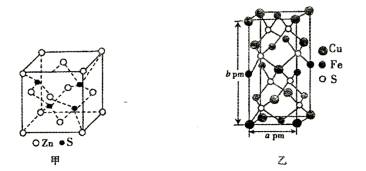
(1)基态Cu原子的价电子排布式为
(2)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是
(3)Ga、As、Se三种元素第一电离能由大到小的顺序是
(4)砷化镓可由(CH3)3Ga和AsH3在700°C下反应制得,反应的方程式为
(5)锌与铜位于同一周期。Zn2+的结构如图印所示,Zn2+的配位数是

您最近一年使用:0次



