(1)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序___ (填序号)。
(2)25℃时,体积相同,浓度均为0.2mol·L-1的氨水和NaOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为___ ;常温下,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为___ ;
(3)用离子方程式解释碳酸钠溶液呈碱性的原因:___ 。
(4)能证明CH3COOH是弱酸的事实是___ 。
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
(2)25℃时,体积相同,浓度均为0.2mol·L-1的氨水和NaOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为
(3)用离子方程式解释碳酸钠溶液呈碱性的原因:
(4)能证明CH3COOH是弱酸的事实是
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
更新时间:2020-06-04 08:38:02
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_______ 。(填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_______ ,水电离出的氢离子的浓度为_______ 。
(3)NaClO溶液中的质子守恒关系为_______ 。
(4)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______ 。
(5)25℃下,将pH=12的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的质子守恒关系为
(4)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(5)25℃下,将pH=12的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是________ 。
A.c(OH﹣) B. C.c(H+)•c(OH﹣) D.
C.c(H+)•c(OH﹣) D.
(2)取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将
的比值将______________ (填“增大”、“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)________ V(乙)( 填“>”、“<”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
相同温度下,pH相同的NaClO和CH3COOK两种溶液中,[c(Na+)-c(ClO-)]___ [c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
(5)常温下,取99mL甲溶液与1mL 1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______ 。
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是
A.c(OH﹣) B.
 C.c(H+)•c(OH﹣) D.
C.c(H+)•c(OH﹣) D.
(2)取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
 的比值将
的比值将(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10﹣5 | 4.3×10﹣7 | 3.0×10﹣8 |
| K2 | ﹣﹣ | 5.6×10﹣11 | ﹣﹣ |
相同温度下,pH相同的NaClO和CH3COOK两种溶液中,[c(Na+)-c(ClO-)]
(5)常温下,取99mL甲溶液与1mL 1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是________ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__________ 。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______ ,溶液中c(CH3COO-)/c(CH3COOH) =________ 。
(2)某温度下, pH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为______ .
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为_____ 。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=______ (写出准确数值)。
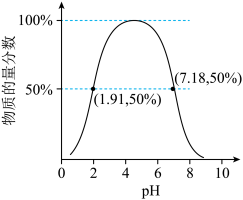
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为_______ ;该二元弱酸的一级电离常数为Ka1,则pKa1=-lgKa1≈____ 。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
(2)某温度下, pH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为

您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】一定温度下,有a.盐酸 b.醋酸两种溶液,试回答(请用字母序号回答):
(1)当物质的量浓度相同时,c(H+)由大到小顺序为_______ 。
(2)等体积等物质的量浓度的两种酸,分别与过量的金属镁反应,开始时产生氢气的速率由大到小顺序为_______ ,产生氢气的总量的大小关系为_______ 。
(3)若两种溶液电离出的c(H+)相同,则两溶液的物质的量浓度的大小关系是_______
(1)当物质的量浓度相同时,c(H+)由大到小顺序为
(2)等体积等物质的量浓度的两种酸,分别与过量的金属镁反应,开始时产生氢气的速率由大到小顺序为
(3)若两种溶液电离出的c(H+)相同,则两溶液的物质的量浓度的大小关系是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】常温时,几种弱酸的电离平衡常数如表所示。
(1) 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ ,通过改变外界条件可以使K值发生变化,则使K值增大需改变的条件是_______ 。
(2)根据表格数据,等浓度的NaClO和Na2SO3溶液,pH较大的是_______ , 相等的
相等的 、
、 、
、 的水溶液中,物质的量浓度由大到小的顺序为
的水溶液中,物质的量浓度由大到小的顺序为_______ 。
(3)Na2CO3溶液呈_______ 性,原因是_______ (写出离子方程式),溶液中离子浓度大小关系为_______ 。
(4)向 溶液中滴加
溶液中滴加 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ ;
| 酸 | 亚硫酸 | 碳酸 | 次氯酸 |
| 电离平衡常数 |  | 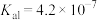 |  |
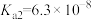 |  |
(1)
 的电离平衡常数表达式K=
的电离平衡常数表达式K=(2)根据表格数据,等浓度的NaClO和Na2SO3溶液,pH较大的是
 相等的
相等的 、
、 、
、 的水溶液中,物质的量浓度由大到小的顺序为
的水溶液中,物质的量浓度由大到小的顺序为(3)Na2CO3溶液呈
(4)向
 溶液中滴加
溶液中滴加 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是___________ 。
a. b.
b. c.
c. d.
d.
(2)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(3)25℃时,将 的醋酸溶液与
的醋酸溶液与 氢氧化钠溶液等体积混合。反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合。反应后溶液恰好显中性,表示醋酸的电离平衡常数
___________ (用含a、b的代数式表示)。
(4)标准状况下将 ,通入
,通入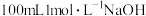 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
___________ 。
| 化学式 |  |  |  |
| 电离平衡常数 |  |   |  |
(1)物质的量浓度均为
 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是a.
 b.
b. c.
c. d.
d.
(2)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:
(3)25℃时,将
 的醋酸溶液与
的醋酸溶液与 氢氧化钠溶液等体积混合。反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合。反应后溶液恰好显中性,表示醋酸的电离平衡常数
(4)标准状况下将
 ,通入
,通入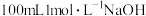 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】现有五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
(1)将1L pH=3的HCl溶液分别与0.001mol·L-1 V1L NH3·H2O溶液、0.001mol·L-1 V2L NaOH溶液充分反应至中性,则V1、V2大小关系为V1_______ V2(填“>”“<”或“=”下同);pH相同的HCl溶液和CH3COOH溶液,加水稀释同等倍数后pH大小关系为:HCl_______ CH3COOH。
(2)浓度均为0.1mol·L-1NH4HSO4与NaOH溶液等体积混合,溶液呈酸性的原因:_______ (用离子方程式表示)
(3)用水稀释0.1 mol·L-1NH3·H2O时,溶液中随着水量的增加而减小的是_______ (填写序号)。
①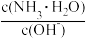 ②
② ③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积
③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积
(4)室温下,将pH=1的HCl溶液aL与pH=12的 NaOH溶液bL混合,所得混合液的pH=3,设混合溶液体积变化忽略不计,则a:b=_______ 。
(5)0.1 mol·L-1 NH4HSO4溶液中各种离子浓度由大到小的顺序是:_______ 。
(1)将1L pH=3的HCl溶液分别与0.001mol·L-1 V1L NH3·H2O溶液、0.001mol·L-1 V2L NaOH溶液充分反应至中性,则V1、V2大小关系为V1
(2)浓度均为0.1mol·L-1NH4HSO4与NaOH溶液等体积混合,溶液呈酸性的原因:
(3)用水稀释0.1 mol·L-1NH3·H2O时,溶液中随着水量的增加而减小的是
①
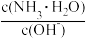 ②
② ③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积
③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积 (4)室温下,将pH=1的HCl溶液aL与pH=12的 NaOH溶液bL混合,所得混合液的pH=3,设混合溶液体积变化忽略不计,则a:b=
(5)0.1 mol·L-1 NH4HSO4溶液中各种离子浓度由大到小的顺序是:
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,向100mL0.01mol·L-1MOH溶液中逐滴加入0.02mol·L-1HA溶液,滴加过程中混合溶液的pH随着HA溶液体积变化如图所示(体积变化忽略不计)。
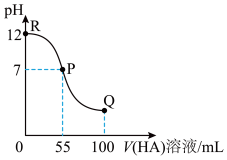
(1)由图中信息可知HA为___________ 酸(填“强”或 “弱”),理由是___________ 。
(2)R点时由水电离出的c(OH-)=___________ mol·L-1。
(3)常温下一定浓度的MA稀溶液中所有离子的浓度由大到小的顺序为:___________ 。
(4)Q点时所得溶液中,c(A-)+c(HA)___________ 2c(M+),c(M+)___________ c(HA)(填“>”、“<”或“=”)。

(1)由图中信息可知HA为
(2)R点时由水电离出的c(OH-)=
(3)常温下一定浓度的MA稀溶液中所有离子的浓度由大到小的顺序为:
(4)Q点时所得溶液中,c(A-)+c(HA)
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】实验室有两瓶0.1 mol/L未知一元酸溶液,分别表示为HA和HB,某小组同学为比较其酸性,测出了两瓶溶液的pH值,结果如下(均为室温下测定):一元酸HA溶液的pH为3,一元酸HB溶液的pH为1。
(1)一元酸HA属于___________ 酸(填“强”、“弱”),HA在水溶液中的电离方程式为___________ 。
(2)HA的酸性比HB___________ (填“强”或“弱”);将V1 mL该HB溶液与V2 mLpH=14的氢氧化钡溶液恰好完全反应,则V1:V2 =___________ 。
(3)将浓度都为0.1 mol/L的HA、NaA、HB、NaB等体积混合,发生反应的离子方程式为___________ 。
(1)一元酸HA属于
(2)HA的酸性比HB
(3)将浓度都为0.1 mol/L的HA、NaA、HB、NaB等体积混合,发生反应的离子方程式为
您最近半年使用:0次



