由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象。
Ⅰ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g) CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
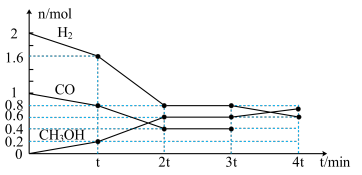
①根据图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率υ(H2)=__ 。
②tmin至2tmin时速率变化的原因可能是__ (要求答出所有可能原因)。
Ⅱ.一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的 。请回答下列问题:
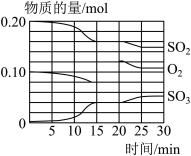
。请回答下列问题:
①SO2的转化率为__ ;
②达到平衡时反应放出的热量为__ 。
Ⅰ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)
 CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
①根据图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率υ(H2)=
②tmin至2tmin时速率变化的原因可能是
Ⅱ.一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的 。请回答下列问题:
。请回答下列问题:①SO2的转化率为
②达到平衡时反应放出的热量为
更新时间:2020-06-11 15:33:42
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】反应A(g) 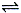 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
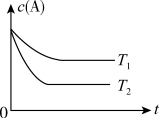
(1)上述反应的温度T1____ T2,平衡常数K(T1)____ K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________ 。
②反应的平衡常数K=_______ 。
③反应在0~5min区间的平均反应速率v(A)=________ 。
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______ 。
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____ 0(填“>”、“<”或“=”)。在______ 填“较高”或“较低”)温度下有利于该反应自发进行。
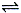 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为
②反应的平衡常数K=
③反应在0~5min区间的平均反应速率v(A)=
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2
 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】现在城市使用的燃料大多数为煤气、液化石油气。煤气的主要成分是 和
和 的混合气,它由煤炭与水(蒸汽)反应制得,故又称水煤气。
的混合气,它由煤炭与水(蒸汽)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学反应方程式:____________________ 。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为

已知 气体燃烧的热化学方程式
气体燃烧的热化学方程式
 。
。
试计算同物质的量的 和
和 完全燃烧产生的热量的比值约为
完全燃烧产生的热量的比值约为__________ 。
(3)已知氢气燃烧的热化学方程式为
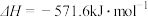 。
。
试计算同质量的氢气和丙烷完全燃烧产生的热量的比值约为__________ 。
(4)氢气是未来的理想能源,除产生的热量大之外,还具有的优点是____________________ 。
 和
和 的混合气,它由煤炭与水(蒸汽)反应制得,故又称水煤气。
的混合气,它由煤炭与水(蒸汽)反应制得,故又称水煤气。(1)试写出制取水煤气的主要化学反应方程式:
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为


已知
 气体燃烧的热化学方程式
气体燃烧的热化学方程式
 。
。试计算同物质的量的
 和
和 完全燃烧产生的热量的比值约为
完全燃烧产生的热量的比值约为(3)已知氢气燃烧的热化学方程式为

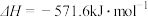 。
。试计算同质量的氢气和丙烷完全燃烧产生的热量的比值约为
(4)氢气是未来的理想能源,除产生的热量大之外,还具有的优点是
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】已知下列热化学方程式,回答下列问题:
①2H2(g)+O2(g)=2H2O(l) ΔH=﹣570kJ•
②2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ•
③2C(s)+O2(g)=2CO(g) ΔH=﹣220.8kJ•
④C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ•
(1)上述反应中属于放热反应的是_____ (填写序号);
(2)H2的燃烧热为_____ ;
(3)燃烧8g H2生成液态水,放出的热量为_____ ;
(4)H2O(l)=H2O(g)ΔH=______ ;
(5)CO的燃烧热的热化学方程式为__ 。
①2H2(g)+O2(g)=2H2O(l) ΔH=﹣570kJ•

②2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ•

③2C(s)+O2(g)=2CO(g) ΔH=﹣220.8kJ•

④C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ•

(1)上述反应中属于放热反应的是
(2)H2的燃烧热为
(3)燃烧8g H2生成液态水,放出的热量为
(4)H2O(l)=H2O(g)ΔH=
(5)CO的燃烧热的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】在2L带气压计的恒容密闭容器中通入2 molX(g)和1molY(g),发生反应:2X(g)+Y(g) 2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为__ 。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲。
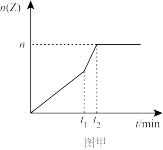
若n=0.9mol,t1时刻改变的条件是__ (填选项编号,A.升温 B.降温 C.加压 D.减压 E.加催化剂),t2__ 5min(填“>”“<”或“=”,下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量__ 0.9mol。
(4)若将物质的量均为3mol的物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
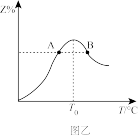
①A、B两点Z物质正反应速率的大小关系是__ ;(速率用A、B表示)
②温度T<T0时,Z%逐渐增大的原因是___ 。
 2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。(1)若反应经历5min达到平衡,则Y的平均反应速率为
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲。

若n=0.9mol,t1时刻改变的条件是
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量
(4)若将物质的量均为3mol的物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。

①A、B两点Z物质正反应速率的大小关系是
②温度T<T0时,Z%逐渐增大的原因是
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g)⇌2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=_____ mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是________
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是______
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________ (用文字表达)。10 min到15 min的曲线变化的原因可能是_________ (填写编号)。
(1)在该平衡时,n(SO3)=
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是

| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3的物质的量 |
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g)⇌2Y(g)+nZ(g)。2min末已生成0.2molY,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率为__ 。
(2)2min末时X的浓度为___ 。
(3)化学反应方程式中n=__ 。
(4)2min末,W的转化率__ 。
(1)前2min内用W的浓度变化表示的平均反应速率为
(2)2min末时X的浓度为
(3)化学反应方程式中n=
(4)2min末,W的转化率
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。则在0~60s时段,反应速率v(N2O4)为
2NO2(g),随温度升高,混合气体的颜色变深。则在0~60s时段,反应速率v(N2O4)为________ mol·L-1·s-1。

 2NO2(g),随温度升高,混合气体的颜色变深。则在0~60s时段,反应速率v(N2O4)为
2NO2(g),随温度升高,混合气体的颜色变深。则在0~60s时段,反应速率v(N2O4)为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05mol•L﹣1•min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________ 。
(2)2min末时X的浓度为_________ 。
(3)化学反应方程式中n的值是____________ 。
(1)前2min内用Y的浓度变化表示的平均反应速率为
(2)2min末时X的浓度为
(3)化学反应方程式中n的值是
您最近一年使用:0次
【推荐1】恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2molB,并测得C的浓度为1.2mol•L-1。
xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2molB,并测得C的浓度为1.2mol•L-1。
(1)A的转化率与B的转化率之比为___ ;物质A的化学反应速率为___ ;x=___ ;
(2)保持温度和容积不变,向平衡体系中再充入2molA和2molB气体,达到新平衡时B的物质的量为___ 。
(3)此反应在该温度时的化学平衡常数为___ 。
 xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2molB,并测得C的浓度为1.2mol•L-1。
xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2molB,并测得C的浓度为1.2mol•L-1。(1)A的转化率与B的转化率之比为
(2)保持温度和容积不变,向平衡体系中再充入2molA和2molB气体,达到新平衡时B的物质的量为
(3)此反应在该温度时的化学平衡常数为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)x值等于________________ ;
(2)A的转化率为________ ;
(3)如果增大反应体系的压强,则平衡体系中C的质量分数________ (增大、减小、不变)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4 /3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入B物质___ mol。
 xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:(1)x值等于
(2)A的转化率为
(3)如果增大反应体系的压强,则平衡体系中C的质量分数
(4)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4 /3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入B物质
您最近一年使用:0次


 CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率

