化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大__ min(填0~1、1~2、2~3、3~4、4~5),原因是___ 。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___ (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是___ 。
A.蒸馏水 B.KCl溶液C.KNO3溶液D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
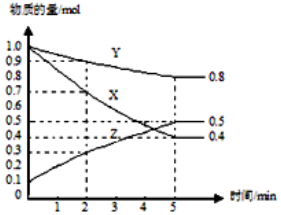
①该反应的化学方程式是___ 。
②该反应达到平衡状态的标志是___ 。
A.Y的体积分数在混合气体中保持不变
B.2v(X)=3v(Z)
C.容器内气体压强保持不变
D.X、Y、Z三种气体的浓度之比为3:1:2
E.生成1molY的同时消耗2molZ
F.容器内气体的平均相对分子质量保持不变
③2min内Y的转化率为___ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是
A.蒸馏水 B.KCl溶液C.KNO3溶液D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是
②该反应达到平衡状态的标志是
A.Y的体积分数在混合气体中保持不变
B.2v(X)=3v(Z)
C.容器内气体压强保持不变
D.X、Y、Z三种气体的浓度之比为3:1:2
E.生成1molY的同时消耗2molZ
F.容器内气体的平均相对分子质量保持不变
③2min内Y的转化率为
更新时间:2020-07-17 22:08:44
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
根据以上信息可知,lmolH2在足量的氯气中燃烧生成氯化氢气体放出的热量是__________ 。
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为IL的密闭容器中充入lmolCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
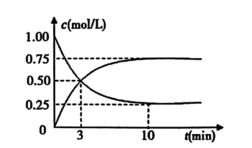
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________ 。
②若反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
A.v(CO2)=0.15mol·L-1·min-1 B.v(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1 D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为________________ (填字母)。
(1)下表中数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能(kJ·mol-1) | 436 | 243 | 431 |
根据以上信息可知,lmolH2在足量的氯气中燃烧生成氯化氢气体放出的热量是
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为IL的密闭容器中充入lmolCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②若反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:A.v(CO2)=0.15mol·L-1·min-1 B.v(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1 D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】 、
、 密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体)。回答下列问题:
密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体)。回答下列问题:
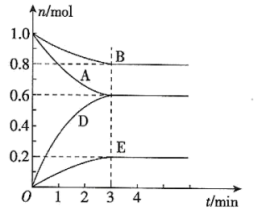
(1)写出该反应的化学方程式:___________ 。
(2)反应开始至 时,用
时,用 表示的平均反应速率为
表示的平均反应速率为___________  。
。
 、
、 密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体)。回答下列问题:
密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体)。回答下列问题:
(1)写出该反应的化学方程式:
(2)反应开始至
 时,用
时,用 表示的平均反应速率为
表示的平均反应速率为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】化学反应速率与限度在生产生活中的运用广泛。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应生成的氢气(标准状况),实验记录如下表(累计值):
在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是___________ ,原因为___________ 。
(2)反应 在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率
在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率___________ (填“增大”、“不变”或“减小”,下同),保持体积不变,充入Ar使体系压强增大,其逆反应速率___________ 。
(3)某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

①该反应的化学方程式为___________ 。
② 0~4 min内,用A的浓度变化来表示该反应的平均反应速率为___________ mol/(L·min)。
③平衡时混合气体中B的体积分数约为___________ (保留3位有效数字)。
④反应达到平衡,此时体系内压强与开始时的压强之比为___________ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应生成的氢气(标准状况),实验记录如下表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(2)反应
 在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率
在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率(3)某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

①该反应的化学方程式为
② 0~4 min内,用A的浓度变化来表示该反应的平均反应速率为
③平衡时混合气体中B的体积分数约为
④反应达到平衡,此时体系内压强与开始时的压强之比为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
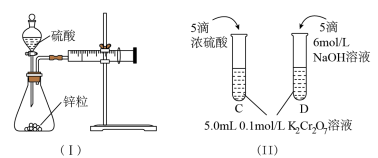
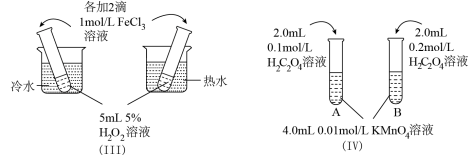
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项):______________________ 。
(2)实验(Ⅱ)已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。D试管中实验现象为
2CrO42-(黄色)+ 2H+。D试管中实验现象为______________ ,用平衡移动原理解释原因:_______________
(3)实验(Ⅲ)中实验目的是探究____________________ 。
(4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A)________ t(B)(填>、<或= )


(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项):
(2)实验(Ⅱ)已知:Cr2O72-(橙色)+ H2O
 2CrO42-(黄色)+ 2H+。D试管中实验现象为
2CrO42-(黄色)+ 2H+。D试管中实验现象为(3)实验(Ⅲ)中实验目的是探究
(4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A)
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】某小组拟用含稀硫酸的KMnO4溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如表的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/LH2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
回答下列问题:
(1)完成上述反应原理的离子方程式:___________________________ 。
(2)上述实验①②是探究________________ 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a为_________ ;
(3)乙是实验需要测量的物理量,则表格中“乙”应填写________ 。上述实验②④是探究___________________ 对化学反应速率的影响。
(4)实验③中加入amL蒸馏水的目的是__________________
(5)为了观察紫色褪去,草酸与高锰酸钾初始的物质的量需要满足的关系n(H2C2O4):n (KMnO4)最小为:_____________ 。
| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(1)完成上述反应原理的离子方程式:
(2)上述实验①②是探究
(3)乙是实验需要测量的物理量,则表格中“乙”应填写
(4)实验③中加入amL蒸馏水的目的是
(5)为了观察紫色褪去,草酸与高锰酸钾初始的物质的量需要满足的关系n(H2C2O4):n (KMnO4)最小为:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】实验
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有___ 和___ 。
(2)锌与盐酸的反应速率可以通过观察___ 进行判断,也可通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是___ 或___ 。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法:在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况下):
①反应速率最快的时间段是____ (填“0~1min”“1~2min”“2~3min”“3~4min”或“4~5min”)。
②试分析1~3min时间段里,反应速率变快的主要原因是____ 。
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有
(2)锌与盐酸的反应速率可以通过观察
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法:在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况下):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
②试分析1~3min时间段里,反应速率变快的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】已知硫代硫酸钠溶液和稀硫酸反应可析出单质硫沉淀:
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
某同学按下表进行实验,请你判断哪一组先出现浑浊。
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
某同学按下表进行实验,请你判断哪一组先出现浑浊。
| 编号 | 1 | 2 | 3 |
| 加3%Na2S2O3溶液 | 5mL | 5mL | 5mL |
| 1:5的硫酸 | 25滴 | 15滴 | 25滴 |
| 温度/℃ | 室温 | 室温+10 | 室温+20 |
| 出现浑浊的快慢 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如表所示:
(1)甲同学的实验目的是_______ 。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
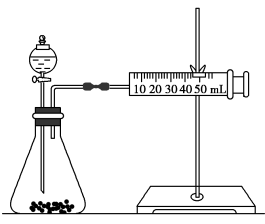
(2)乙同学在实验中应该测定的数据是_______ 。
(3)乙同学完成该实验应选用的实验药品是_______ 。
甲同学研究的实验报告如表所示:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L硫酸溶液于三支试管中 ②向三支试管中分别投入大小、形状相同的Cu、Fe、Mg | 反应速率: ,Cu不反应 ,Cu不反应 | 金属的性质越活泼,反应速率越快 |
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(2)乙同学在实验中应该测定的数据是
(3)乙同学完成该实验应选用的实验药品是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】“碘钟”实验中,3I-+ =
= + 2
+ 2 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是_______ 。
(2)显色时间t1=_______ 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为_______ (填字母)。
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_______ 。
 =
= + 2
+ 2 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t /s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是
(2)显色时间t1=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:
回答下列问题:
(1)已知 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则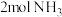 完全分解吸收的能量为
完全分解吸收的能量为_______ kJ。
(2)实验①中20~40min,
_______ 。
(3)实验③达到平衡后, 的体积分数约为
的体积分数约为_______ (保留三位有效数字)。
(4)下列能说明该反应达到平衡状态的是_______ (填序号)
a.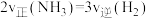 b.
b. 保持不变
保持不变
c. 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变
e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是_______ (填序号)
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
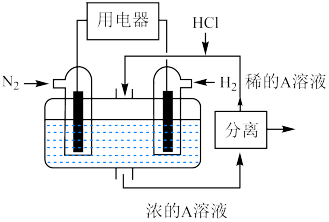
(6)有人设想以 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为_______ ,A为_______ (填化学式)。
 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:| 编号 | 时间min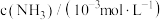 表面积/  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
(1)已知
 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则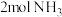 完全分解吸收的能量为
完全分解吸收的能量为(2)实验①中20~40min,

(3)实验③达到平衡后,
 的体积分数约为
的体积分数约为(4)下列能说明该反应达到平衡状态的是
a.
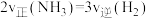 b.
b. 保持不变
保持不变c.
 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
(6)有人设想以
 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
您最近一年使用:0次
【推荐2】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
 已知该反应在2404℃时,平衡常数
已知该反应在2404℃时,平衡常数 。
。
(1)某温度下,向 的密闭容器中充入
的密闭容器中充入 和
和 各
各 ,5分钟后
,5分钟后 的物质的量为
的物质的量为 ,则
,则 的反应速率为
的反应速率为___________ 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是___________。
(3)将 、
、 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是_______ 。
A. B.
B.  C.
C.
(4)向恒温恒容的密闭容器中充入等物质的量的 和
和 ,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数
,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数___________ (填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内 、
、 、NO的浓度分别为
、NO的浓度分别为 、
、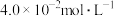 和
和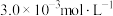 ,此时反应
,此时反应_______ (填“处于化学平衡状态“向正反应方向进行”或“向逆反应方向进行”)。
(6)
根据上图中的能量变化数据,计算反应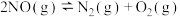 的
的
___________ 。

 已知该反应在2404℃时,平衡常数
已知该反应在2404℃时,平衡常数 。
。(1)某温度下,向
 的密闭容器中充入
的密闭容器中充入 和
和 各
各 ,5分钟后
,5分钟后 的物质的量为
的物质的量为 ,则
,则 的反应速率为
的反应速率为(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是___________。
A.消耗 同时生成 同时生成 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D. |
(3)将
 、
、 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是A.
 B.
B.  C.
C.
(4)向恒温恒容的密闭容器中充入等物质的量的
 和
和 ,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数
,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数(5)该温度下,某时刻测得容器内
 、
、 、NO的浓度分别为
、NO的浓度分别为 、
、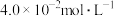 和
和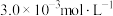 ,此时反应
,此时反应(6)

根据上图中的能量变化数据,计算反应
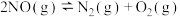 的
的
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】回答下列问题:
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
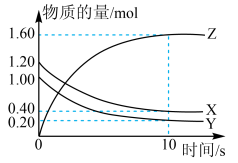
①此反应的化学方程式为________________ ;
②0~10s内,用Z表示的化学反应速率为_____________ ;
③X的转化率为________________ 。
(2)恒温恒容时,某密闭容器中发生反应:
C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是_____ 。
①C(s)的浓度不再改变
②CO2的体积分数不再改变
③气体的质量不再改变
④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2
⑦v正(CO2)=2v逆(CO)
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则

①此反应的化学方程式为
②0~10s内,用Z表示的化学反应速率为
③X的转化率为
(2)恒温恒容时,某密闭容器中发生反应:
C(s)+CO2(g)
 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是①C(s)的浓度不再改变
②CO2的体积分数不再改变
③气体的质量不再改变
④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2
⑦v正(CO2)=2v逆(CO)
您最近一年使用:0次



