下表是元素周期表的短周期部分,表中的数字序号代表该元素,请参照元素在表中位置,回答下列问题:

(1)写出元素⑤在周期表中的位置为_____________ 。元素⑥的原子结构示意图为_____________ 。
(2)写出①和③形成简单氢化物的电子式_____________ 。表中元素形成的最高价氧化物对应的水化物中,碱性最强的是_____________ (填化学式)。酸性最强的是________ (填化学式)。
(3)元素④的单质着火时_____________ (填“能”或“不能”)用水扑灭,用离子方程式表示其原因_____________ 。
(4)可用来判断元素⑦、⑧非金属性强弱的是_____________ 。
a.原子的最外层电子数b.单质与氢气化合的难易程度
c.简单气态氢化物的热稳定性d.其氧化物对应水化物的酸性
(5)某同学为了比较元素②⑥⑦的非金属性强弱,用图所示装置进行实验,可供选择的试剂有盐酸、硫酸、Na2CO3、Na2SiO3溶液。A中盛放的试剂为_____________ 。能说明元素②与元素⑥非金属性
强弱的离子方程式为_____________ 。
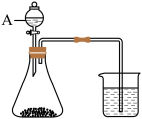
(6)元素硒(Se)与元素⑦在同一主族,俗称“长寿元素”,在营养强化剂中硒元素主要以亚硒酸钠形式存在,写出亚硒酸钠的化学式_____________ 。

(1)写出元素⑤在周期表中的位置为
(2)写出①和③形成简单氢化物的电子式
(3)元素④的单质着火时
(4)可用来判断元素⑦、⑧非金属性强弱的是
a.原子的最外层电子数b.单质与氢气化合的难易程度
c.简单气态氢化物的热稳定性d.其氧化物对应水化物的酸性
(5)某同学为了比较元素②⑥⑦的非金属性强弱,用图所示装置进行实验,可供选择的试剂有盐酸、硫酸、Na2CO3、Na2SiO3溶液。A中盛放的试剂为
强弱的离子方程式为

(6)元素硒(Se)与元素⑦在同一主族,俗称“长寿元素”,在营养强化剂中硒元素主要以亚硒酸钠形式存在,写出亚硒酸钠的化学式
更新时间:2020-07-30 10:14:22
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
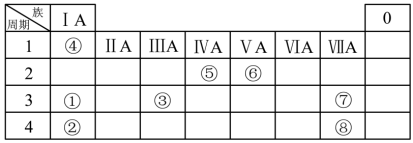
【推荐1】几种主族元素在周期表中的位置如下
(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是_______ 。
(2)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式)。
(3)①③⑦三种元素所形成的简单离子的半径由大到小的顺序是_______ (用元素的离子符号表示)。
(4)⑥元素最高价氧化物的水化物的浓溶液不稳定,受热或见光易分解,写出该反应的化学方程式_______ 。⑥的气态氢化物与⑦的气态氢化物水溶液反应生成X,写出X的电子式_______ ,X中含有的化学键类型有_______ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦的氧化物对应的水化物的酸性强于⑧的氧化物对应的水化物的酸性
c.⑦的单质能将⑧的单质从其钠盐溶液中置换出来
(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是
(2)①②③三种元素最高价氧化物对应水化物碱性最强的是
(3)①③⑦三种元素所形成的简单离子的半径由大到小的顺序是
(4)⑥元素最高价氧化物的水化物的浓溶液不稳定,受热或见光易分解,写出该反应的化学方程式
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦的氧化物对应的水化物的酸性强于⑧的氧化物对应的水化物的酸性
c.⑦的单质能将⑧的单质从其钠盐溶液中置换出来
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。人体必需的一些元素在周期表中的分布情况如下:
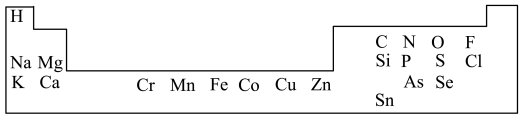
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为______ 。
(2)第三周期半径最小的简单离子为______ 。
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石 属于
属于______ (填“酸”、“碱”、“盐”或“氧化物”)。Ca与Mg在元素周期表同一族,化学性质相似同时也有递变性,试写出Ca与 反应的化学方程式:
反应的化学方程式:____________ 。
(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是______ ,原子序数为______ 。
(5)由元素C和O形成的三核直线形分子的结构式为______ 。
(6)用电子式表示元素Na和S的原子形成的化合物(该化合物含有三个原子核)的形成过程:____________ 。
(7)能比较元素S和Cl非金属性强弱的实验事实是______ (填字母)。
a. 的酸性比HCl的酸性弱
的酸性比HCl的酸性弱
b.单质 与
与 化合比单质S与
化合比单质S与 化合容易,且HCl的稳定性比
化合容易,且HCl的稳定性比 的强
的强
c.向 的水溶液中通入少量
的水溶液中通入少量 可置换出单质S
可置换出单质S

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)第三周期半径最小的简单离子为
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石
 属于
属于 反应的化学方程式:
反应的化学方程式:(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(5)由元素C和O形成的三核直线形分子的结构式为
(6)用电子式表示元素Na和S的原子形成的化合物(该化合物含有三个原子核)的形成过程:
(7)能比较元素S和Cl非金属性强弱的实验事实是
a.
 的酸性比HCl的酸性弱
的酸性比HCl的酸性弱b.单质
 与
与 化合比单质S与
化合比单质S与 化合容易,且HCl的稳定性比
化合容易,且HCl的稳定性比 的强
的强c.向
 的水溶液中通入少量
的水溶液中通入少量 可置换出单质S
可置换出单质S
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】四种短周期元素X、Y、Z、W在周期表中的位置如表所示,其中Z元素的最外层电子数是内层电子总数的 。试回答下列问题。
。试回答下列问题。
(1)Y元素在元素周期表中的位置___________ 。四种元素中原子半径最大的是___________ (填元素符号)。
(2)写出Y的氧化物的一种用途___________ 。
(3)能证明W的非金属性强于Y的事实是___________ 。
a.W的氢化物水溶液显酸性,Y的氢化物不显酸性
b.Y的氢化物不如W的氢化物稳定
c.简单阴离子的还原性:Y>W
(4)+2价X的氧化物可将W的+4价氧化物还原为W单质,恢复至室温时,生成1 mol W放热269.0 kJ,则该反应的热化学方程式为___________ 。
(5)W的最高价氧化物对应的水化物可以氧化Z的氢化物,并将Z氧化为最高价氧化物,写出反应的化学方程式___________ 。氧化1 mol Z的氢化物转移电子的物质的量为___________ 。
 。试回答下列问题。
。试回答下列问题。X | ||
Y | Z | W |
(1)Y元素在元素周期表中的位置
(2)写出Y的氧化物的一种用途
(3)能证明W的非金属性强于Y的事实是
a.W的氢化物水溶液显酸性,Y的氢化物不显酸性
b.Y的氢化物不如W的氢化物稳定
c.简单阴离子的还原性:Y>W
(4)+2价X的氧化物可将W的+4价氧化物还原为W单质,恢复至室温时,生成1 mol W放热269.0 kJ,则该反应的热化学方程式为
(5)W的最高价氧化物对应的水化物可以氧化Z的氢化物,并将Z氧化为最高价氧化物,写出反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】同周期元素从左到右失电子能力逐渐减弱。某研究性学习小组为了用实验的方法验证镁和铝的失电子能力强弱,学生甲和学生乙分别设计了两种不同的方案。
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)上述两个实验方案中实验现象较为明显的是方案__________ 。
(2)学生乙在实验时取了一段黑色的镁带投入稀盐酸中,现象并不明显,请分析原因____________________ 。
(3)学生丙用镁、铝的可溶性盐溶液及一些其他化学试剂进行实验也得出了正确结论,简述学生丙采用的方法:__________________________________________________ 。
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)上述两个实验方案中实验现象较为明显的是方案
(2)学生乙在实验时取了一段黑色的镁带投入稀盐酸中,现象并不明显,请分析原因
(3)学生丙用镁、铝的可溶性盐溶液及一些其他化学试剂进行实验也得出了正确结论,简述学生丙采用的方法:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
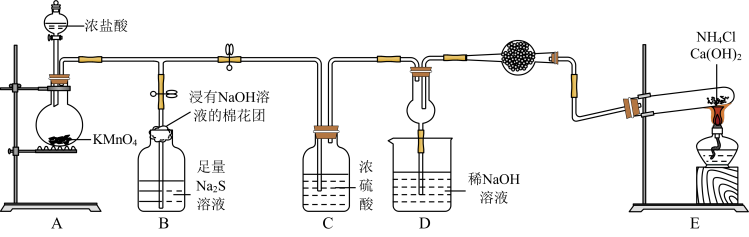
回答下列问题:
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
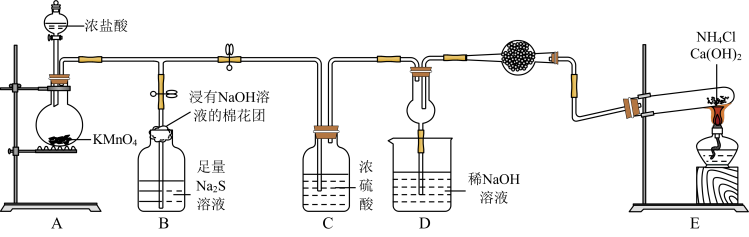
回答下列问题:
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】为证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。

I.实验过程:
①打开弹簧夹,打开活塞 a,滴加浓盐酸。
②当 B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当 B 中溶液由黄色变为棕红色时,关闭活塞 a。
④……
(1)B中溶液发生反应的离子方程式为___________ 。
(2)为验证溴的氧化性强于碘,过程④的操作和现象是___________ 。
(3)过程③的实验目的是__ 。
(4)请从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:__
Ⅱ.实验过程中需用到 20mL1mol/L NaBr溶液。
(5)配制 20mL1mol/L NaBr溶液需用托盘天平称取NaBr固体的质量为__ g;
(6)在配制过程中,下列实验操作对所配制溶液的物质的量浓度偏高的有___________。

I.实验过程:
①打开弹簧夹,打开活塞 a,滴加浓盐酸。
②当 B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当 B 中溶液由黄色变为棕红色时,关闭活塞 a。
④……
(1)B中溶液发生反应的离子方程式为
(2)为验证溴的氧化性强于碘,过程④的操作和现象是
(3)过程③的实验目的是
(4)请从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:
Ⅱ.实验过程中需用到 20mL1mol/L NaBr溶液。
(5)配制 20mL1mol/L NaBr溶液需用托盘天平称取NaBr固体的质量为
(6)在配制过程中,下列实验操作对所配制溶液的物质的量浓度偏高的有___________。
| A.称量时将NaBr固体放在右盘; |
| B.用烧杯溶解NaBr 固体后,洗涤烧杯2~3次,洗涤液未转移到容量瓶; |
| C.溶液注入容量瓶前没有恢复到室温就进行定容; |
| D.定容时俯视观察凹液面。 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素。X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:
(1)写出下列元素符号:Y________ Z ________ W ________ R __________
(2)写出下列化合物的电子式:乙__________ 丙____________
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:_____________________
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:____
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | X:Z=1:1 | Y:X=1:2 | W:Z=1:1 | W:R=2:1 |
(2)写出下列化合物的电子式:乙
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可与A形成10电子分子,B、C位于同一周期,二者可以形成多种共价化合物,C、F位于同一主族元素,B元素原子最外电子层的P能级上的电子处于半满状态,C元素原子的最外层电子数是内层电子总数的3倍,E元素原子最外层电子数比最内层电子数多1。
请回答下列问题:
(1)E元素基态原子的电子排布式为___ 。
(2)F元素原子的价电子轨道表示式为___ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的酸的化学式为___ 。
(4)离子半径:D+___ (填“<”“>”或“=”,下同)B3-,第一电离能:B___ C,电负性:C___ F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1:1,X的电子式为___ ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:___ 。
请回答下列问题:
(1)E元素基态原子的电子排布式为
(2)F元素原子的价电子轨道表示式为
(3)F、G元素对应的最高价含氧酸中酸性较强的酸的化学式为
(4)离子半径:D+
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1:1,X的电子式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】已知:①X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯卡尔鲍林在1932年提出electronegativity作为元素原子在化合物中某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的electronegativity的值。
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,_______ (填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_______ 。
(3)W、R、Q单核简单离子半径由大到小排列顺序为_______ (用微粒符号表示)。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式_______ 。
(5)一种由元素W、R组成的淡黄色固体化合物,其电子式为_______ 。
(6)试比较下列物质的稳定性:X2W_______ X2Q;沸点:X2W _______ X2Q (填“<”或“>”)。
(7)元素X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_______ 。
A.2 B.4 C.7 D.8
②莱纳斯卡尔鲍林在1932年提出electronegativity作为元素原子在化合物中某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的electronegativity的值。
| 元素 | X | Y | Z | W | R | Q |
| electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
| 元素 | Mg | Li | Al | Cl | P | Be |
| electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
(1)根据上表给出的数据,可知元素的electronegativity越大,
(2)元素Q在周期表中的位置为
(3)W、R、Q单核简单离子半径由大到小排列顺序为
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式
(5)一种由元素W、R组成的淡黄色固体化合物,其电子式为
(6)试比较下列物质的稳定性:X2W
(7)元素X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是
A.2 B.4 C.7 D.8
您最近一年使用:0次



