研究化学反应时,既要关注物质变化, 又要关注能量变化。请回答以下问题.
(1)氢气在氧气中燃烧 ,破坏1mol H-H 键吸收Q1 kJ 的热量,破坏 1 mol O=O 键吸收Q2kJ 的热量, 形成 1 mol H—O 键释放Q3kJ 的热量,则下列关系式正确的是。_____ (填字母序号)
A 2Q1+Q2>4Q3 B Q1+Q 2<Q3
C 2Q 1+ Q 2<4Q3 D 2 Q1+Q 2=4Q3
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①2N2(g)+ CO2(g)+ 2H2O(g)= CH4(g)+ 4NO(g) ΔH1=akJ/mol
②CH4(g)+ 4NO2(g)= 4 NO(g)+ CO2(g) + 2 H2O(g) ΔH2 = b kJ/mol
③H2O(1)= H2O(g)ΔH3 =c kJ/mol
则CH4(g)+2NO2(g)=N2(g)+ CO2(g)+ 2H2O(1) ΔH=_______ kJ/mol (用含a、b、c的代数式表示)。
(3)红磷 P(s)和Cl2(g) 发生反应生成PCl3(g)和 PCl5(g), 反应过程中的热量关系如图所示(图中的ΔH表示生成 1mol 产物的数据)。
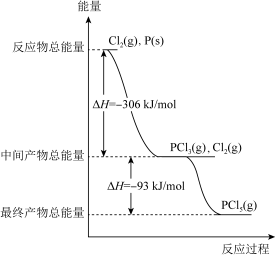
根据如图回答下列问题:
①写出P(s)和Cl2(g)反应生成PCl5(g)的热化学方程式________ ;
②已知:常温时红磷比白磷稳定,比较下列反应中ΔH 的大小:ΔH1___ ΔH2(填“> ”、“< ”或“= ”)。
i.P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1< 0
ii.4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2< 0
(1)氢气在氧气中燃烧 ,破坏1mol H-H 键吸收Q1 kJ 的热量,破坏 1 mol O=O 键吸收Q2kJ 的热量, 形成 1 mol H—O 键释放Q3kJ 的热量,则下列关系式正确的是。
A 2Q1+Q2>4Q3 B Q1+Q 2<Q3
C 2Q 1+ Q 2<4Q3 D 2 Q1+Q 2=4Q3
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①2N2(g)+ CO2(g)+ 2H2O(g)= CH4(g)+ 4NO(g) ΔH1=akJ/mol
②CH4(g)+ 4NO2(g)= 4 NO(g)+ CO2(g) + 2 H2O(g) ΔH2 = b kJ/mol
③H2O(1)= H2O(g)ΔH3 =c kJ/mol
则CH4(g)+2NO2(g)=N2(g)+ CO2(g)+ 2H2O(1) ΔH=
(3)红磷 P(s)和Cl2(g) 发生反应生成PCl3(g)和 PCl5(g), 反应过程中的热量关系如图所示(图中的ΔH表示生成 1mol 产物的数据)。

根据如图回答下列问题:
①写出P(s)和Cl2(g)反应生成PCl5(g)的热化学方程式
②已知:常温时红磷比白磷稳定,比较下列反应中ΔH 的大小:ΔH1
i.P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1< 0
ii.4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2< 0
19-20高二下·重庆·期末 查看更多[6]
陕西省武功县普集高级中学2023-2024学年高二上学期10月月考化学试题山西省山西师范大学实验学校2021-2022学年高二上学期第二次月考化学试题陕西省汉中市部分高中2020-2021学年高二上学期12月月考化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)重庆市第一中学2019-2020学年高二下学期期末考试化学试题
更新时间:2020-08-05 21:40:27
|
相似题推荐
【推荐1】回答下列问题
(1)有机物M经过太阳光光照可转化成N,转化过程为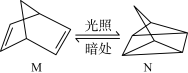
 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是______ 。
(2)已知 的摩尔燃烧焓为
的摩尔燃烧焓为 ,
,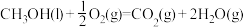
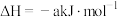 ,则a
,则a______ (填“>”“<”或“=”)726.5。
(3)反应 过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
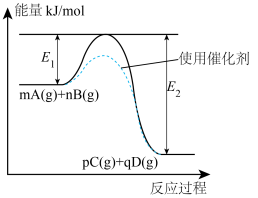
该反应
______ kJ/mol(用含E1、E2式子表示);
在反应体系中加入催化剂,该反应的∆H______ (填增大、减小、不变)。
(4)已知常温时红磷比白磷稳定,
已知:①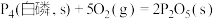 ∆H1
∆H1
②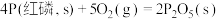 ∆H2
∆H2
比较反应中 的大小:∆H1 ∆H2(填“>”、“<”或“=”)。
的大小:∆H1 ∆H2(填“>”、“<”或“=”)。
(5)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①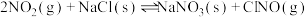 ∆H1
∆H1
②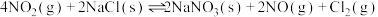 ∆H2
∆H2
③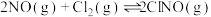 ∆H3
∆H3
则∆H3= (用∆H1和∆H2表示)。
(6)已知断裂1mol某些共价键需要的能量如下表:
N2与O2合成NO的热化学方程式可以表示为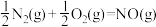
 ,则∆H=
,则∆H=______ .
(1)有机物M经过太阳光光照可转化成N,转化过程为

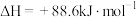 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是(2)已知
 的摩尔燃烧焓为
的摩尔燃烧焓为 ,
,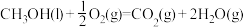
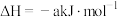 ,则a
,则a(3)反应
 过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
该反应

在反应体系中加入催化剂,该反应的∆H
(4)已知常温时红磷比白磷稳定,
已知:①
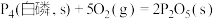 ∆H1
∆H1②
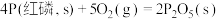 ∆H2
∆H2比较反应中
 的大小:∆H1 ∆H2(填“>”、“<”或“=”)。
的大小:∆H1 ∆H2(填“>”、“<”或“=”)。(5)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①
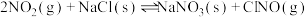 ∆H1
∆H1②
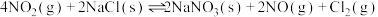 ∆H2
∆H2③
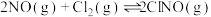 ∆H3
∆H3则∆H3= (用∆H1和∆H2表示)。
(6)已知断裂1mol某些共价键需要的能量如下表:
断裂的共价键 |
|
|
|
需要的能量/kJ | 498 | 945 | 630 |
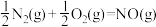
 ,则∆H=
,则∆H=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________ 。
(2)已知在一定温度下:
①C(s)+CO2(g) 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:________ ,△H3=________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是________ 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________ 。
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:
(2)已知在一定温度下:
①C(s)+CO2(g)
 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】工业上制备BaCl2的工艺流程图如图:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C (s) 4CO(g) +BaS(s) △H1=+571kJ·mol-1①
4CO(g) +BaS(s) △H1=+571kJ·mol-1①
BaSO4 (s) +2C (s) 2CO2 (g) +BaS(s) △H=+226kJ·mol-1②
2CO2 (g) +BaS(s) △H=+226kJ·mol-1②
(1)反应C(s) +CO2 (g) 2CO (g)的△H=
2CO (g)的△H=_______ kJ·mol-1。
(2)气体用过量NaOH溶液吸收,得到Na2S,在Na2S水溶液中c(Na+)与c (S-2)的关系是_______ 。(填字母)
A.c(Na+ ) =2c(S2-) B.c(Na+) <2c(S2-)
C.c(Na+) >2c(S2-) D.2c(Na+) >c(S2-)
(3)向AgNO3溶液中加入BaCl2和KBr,当两种沉淀共存时,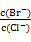 =
=___________ 。
[KSP (AgBr) =5.4×l0-13, Ksp (AgCl) =2.0×10-10]
(4)常温常压下,空气中的CO2溶于水达到平衡时,溶液的pH=5.6,溶液c(H2CO3) =1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3H2CO3-+H+的平衡常数K1=_______ 。(保留两位有效数字)(已知:10-5.60=2.5× 10-6)

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C (s)
 4CO(g) +BaS(s) △H1=+571kJ·mol-1①
4CO(g) +BaS(s) △H1=+571kJ·mol-1①BaSO4 (s) +2C (s)
 2CO2 (g) +BaS(s) △H=+226kJ·mol-1②
2CO2 (g) +BaS(s) △H=+226kJ·mol-1②(1)反应C(s) +CO2 (g)
 2CO (g)的△H=
2CO (g)的△H=(2)气体用过量NaOH溶液吸收,得到Na2S,在Na2S水溶液中c(Na+)与c (S-2)的关系是
A.c(Na+ ) =2c(S2-) B.c(Na+) <2c(S2-)
C.c(Na+) >2c(S2-) D.2c(Na+) >c(S2-)
(3)向AgNO3溶液中加入BaCl2和KBr,当两种沉淀共存时,
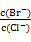 =
=[KSP (AgBr) =5.4×l0-13, Ksp (AgCl) =2.0×10-10]
(4)常温常压下,空气中的CO2溶于水达到平衡时,溶液的pH=5.6,溶液c(H2CO3) =1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3H2CO3-+H+的平衡常数K1=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为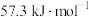 )的实验装置如图所示。
)的实验装置如图所示。
某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定 溶液的温度
溶液的温度
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:
 kJ/mol
kJ/mol
反应Ⅲ:
 kJ/mol
kJ/mol
反应Ⅱ的热化学方程式:_______ 。
(3)由气态基态原子形成1 mol化学键释放的最低能量叫做键能。已知下表中所列键能数据,则

_______ kJ/mol
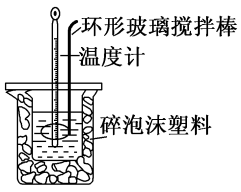
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为_______ ,若将负极材料改为 ,写出其负极反应方程式
,写出其负极反应方程式_______ 。
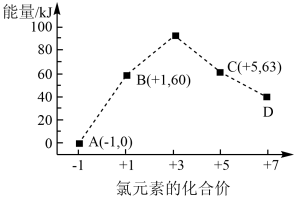
(5)一定条件下,在水溶液中均为1mol的下列离子 、
、 、
、 、
、 、
、 的能量(kJ)相对大小如图所示,则
的能量(kJ)相对大小如图所示,则 的
的
_______ kJ/mol。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为
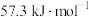 )的实验装置如图所示。
)的实验装置如图所示。
某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定
 溶液的温度
溶液的温度(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:

 kJ/mol
kJ/mol反应Ⅲ:

 kJ/mol
kJ/mol反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1 mol化学键释放的最低能量叫做键能。已知下表中所列键能数据,则


| 化学键 |  |  |  |
| 键能/kJ/mol | a | b | c |
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为
 ,写出其负极反应方程式
,写出其负极反应方程式
(5)一定条件下,在水溶液中均为1mol的下列离子
 、
、 、
、 、
、 、
、 的能量(kJ)相对大小如图所示,则
的能量(kJ)相对大小如图所示,则 的
的

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
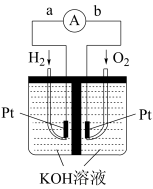
(1)某同学做如图实验,以检验反应中的能量变化。

①实验中发现反应后,(a)中温度升高,由此可以判断(a)中反应是______ 热反应;(b)中______ 温度,由此可以判断(b)中反应是吸热反应。
②写出(a)中反应的离子方程式:______ 。
(2)已知1molCH3OH(l)完全燃烧生成液态水放出726.5kJ热量, ,则
,则
______ 726.5(填“>”“ ”或“=”)。
”或“=”)。
(3)若适量的 和
和 完全反应,每生成
完全反应,每生成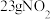 需要吸收
需要吸收 热量。则其热化学方程式为
热量。则其热化学方程式为______ 。
(4)已知断裂1molH—H键、1molO—O键、1molO—H键需要吸收的能量分别为akJ、 、
、 。则
。则 在
在 中燃烧生成气态水的热化学方程式为
中燃烧生成气态水的热化学方程式为______ 。
(1)某同学做如图实验,以检验反应中的能量变化。

①实验中发现反应后,(a)中温度升高,由此可以判断(a)中反应是
②写出(a)中反应的离子方程式:
(2)已知1molCH3OH(l)完全燃烧生成液态水放出726.5kJ热量,
 ,则
,则
 ”或“=”)。
”或“=”)。(3)若适量的
 和
和 完全反应,每生成
完全反应,每生成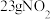 需要吸收
需要吸收 热量。则其热化学方程式为
热量。则其热化学方程式为(4)已知断裂1molH—H键、1molO—O键、1molO—H键需要吸收的能量分别为akJ、
 、
、 。则
。则 在
在 中燃烧生成气态水的热化学方程式为
中燃烧生成气态水的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题。
(1)①C(s)+O2(g)=CO2(g) =-437.3kJ/mol
=-437.3kJ/mol
②H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)  =-285.8 kJ/mol
=-285.8 kJ/mol
③CO(g)+ O2(g)=CO2(g)
O2(g)=CO2(g)  =-283.0 kJ/mol
=-283.0 kJ/mol
固态碳和水蒸气反应生成CO和H2的热化学方程式为___________ 。
(2)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 为
为___________ 。
(3)标准状况下,3.36L仅由C、H元素组成的某气体质量4.5g完全燃烧生成CO2(g)和H2O(l)时,放出233.97kJ的热量,该气体的分子式为___________ ,热值为___________ kJ/g,该气体燃烧热的热化学方程式为___________ 。
(1)①C(s)+O2(g)=CO2(g)
 =-437.3kJ/mol
=-437.3kJ/mol②H2(g)+
 O2(g)=H2O(g)
O2(g)=H2O(g)  =-285.8 kJ/mol
=-285.8 kJ/mol③CO(g)+
 O2(g)=CO2(g)
O2(g)=CO2(g)  =-283.0 kJ/mol
=-283.0 kJ/mol固态碳和水蒸气反应生成CO和H2的热化学方程式为
(2)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热
 为
为| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
您最近一年使用:0次