(1)常温下,某溶液中由水电离出的离子浓度符合 的溶液,其pH为
的溶液,其pH为________ ,此时水的电离受到________ (填“促进”或“抑制”)。
(2)已知:
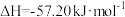 。一定温度下,在密闭容器中反应
。一定温度下,在密闭容器中反应 达到平衡。其他条件不变时,下列措施能提高NO2转化率的是
达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____ (填序号)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13,则该温度下:
①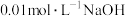 溶液的pH=
溶液的pH=________ 。
②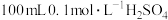 溶液与
溶液与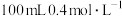 的
的 溶液混合后,pH=
溶液混合后,pH= ________ 。
(4)已知一溶液有4种离子: 、
、 、
、 、
、 ,下列分析结果肯定错误的是
,下列分析结果肯定错误的是________ (填序号)。
A.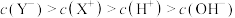 B.
B.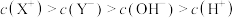
C.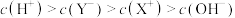 D.
D.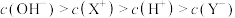
(5)在25℃下,将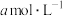 的氨水与
的氨水与 的盐酸等体积混合,反应时溶液中
的盐酸等体积混合,反应时溶液中 ,则溶液显
,则溶液显_____ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数Kb=
的电离常数Kb=______ 。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25℃):
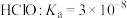

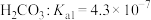 ,
, 
“84消毒液”中通入少量的CO2,该反应的化学方程式为________ 。
 的溶液,其pH为
的溶液,其pH为(2)已知:

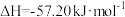 。一定温度下,在密闭容器中反应
。一定温度下,在密闭容器中反应 达到平衡。其他条件不变时,下列措施能提高NO2转化率的是
达到平衡。其他条件不变时,下列措施能提高NO2转化率的是A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13,则该温度下:
①
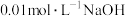 溶液的pH=
溶液的pH=②
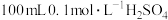 溶液与
溶液与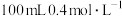 的
的 溶液混合后,pH=
溶液混合后,pH= (4)已知一溶液有4种离子:
 、
、 、
、 、
、 ,下列分析结果肯定错误的是
,下列分析结果肯定错误的是A.
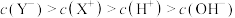 B.
B.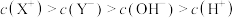
C.
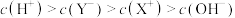 D.
D.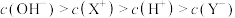
(5)在25℃下,将
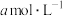 的氨水与
的氨水与 的盐酸等体积混合,反应时溶液中
的盐酸等体积混合,反应时溶液中 ,则溶液显
,则溶液显 的电离常数Kb=
的电离常数Kb=(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25℃):
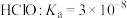

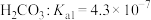 ,
, 
“84消毒液”中通入少量的CO2,该反应的化学方程式为
更新时间:2020-09-21 21:20:08
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】近年来,我国大力加强温室气体 氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。
氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。
(1)已知:①


②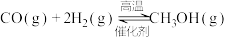


则反应③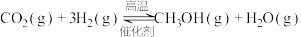

_______  。
。
(2)若将物质的量之比为1∶3的 (g)和
(g)和 (g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下
(g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
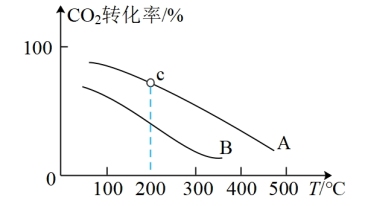
a.A、B两条曲线的压强分别为 、
、 ,则
,则
_______ (填“>”、“<”或“=”) ;
;
b.在曲线A的条件下,起始充入 (g)和
(g)和 (g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应
(g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应 转化率为
转化率为_______ 。
(3)在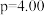 MPa、原料气
MPa、原料气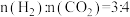 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 选择性
选择性 。
。

a. 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是_______ ;
b. 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是_______ ;
c.写出240℃时反应①的平衡常数的表达式:_______ 。
(4)除调控合适的温度外,使 选择性增大的方法有
选择性增大的方法有_______ 。
 氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。
氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。(1)已知:①



②
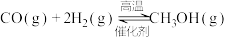


则反应③
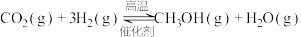

 。
。(2)若将物质的量之比为1∶3的
 (g)和
(g)和 (g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下
(g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
a.A、B两条曲线的压强分别为
 、
、 ,则
,则
 ;
;b.在曲线A的条件下,起始充入
 (g)和
(g)和 (g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应
(g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应 转化率为
转化率为(3)在
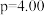 MPa、原料气
MPa、原料气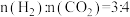 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 选择性
选择性 。
。
a.
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是b.
 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是c.写出240℃时反应①的平衡常数的表达式:
(4)除调控合适的温度外,使
 选择性增大的方法有
选择性增大的方法有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g) 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:
当Cl2与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为____ kJ.
(2)在一个恒容密闭容器中充入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
①T1________ T2(填“>“”<”或”=”)。
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
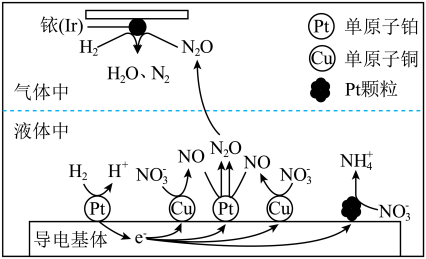
①Ir表面发生反应的方程式为_____________ 。
②若导电基体上的Pt颗粒增多,造成的后果是______________ 。
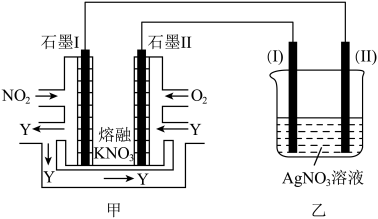
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
 请回答下列问题:
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为________ 。
②若用10A的电流电解60min后,乙中阴极得到32.4gAg,则该电解池的电解效率为____ %。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g)
 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
| 键能(kJ/mol) | 243 | 200 | 607 | 630 |
(2)在一个恒容密闭容器中充入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
t/min 温度/℃ | 0 | 5 | 8 | 13 |
T1 | 2 | 1.5 | 1.3 | 1.0 |
T2 | 2 | 1.15 | 1.0 | 1.0 |
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示

①Ir表面发生反应的方程式为
②若导电基体上的Pt颗粒增多,造成的后果是
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
 请回答下列问题:
请回答下列问题:(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为
②若用10A的电流电解60min后,乙中阴极得到32.4gAg,则该电解池的电解效率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(1)将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)═ CO2(g) △H═-393.5 kJ/mol
CO2(g)+C(s)═ 2CO(g) △H═+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:4Fe(s)+3O2(g)═ 2Fe2O3(s) △H═-648.42 kJ/mol
根据上面三个热化学方程式,回答下列问题:
①高炉内Fe2O3被CO还原为Fe的热化学方程式为________________________ 。
②炼制含铁96%的生铁时,实际生产中所需焦炭远高于理论用量,其原因是_________ 。
(2)在10 L容器中,加入2 mol的SO2(g)和2 mol的NO2(g),保持温度恒定发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:
①化学平衡将_______ (填“向正反应方向”或“向逆反应方向”或“不”)移动;
②当达到新的平衡状态时,容器中SO2(g)的浓度是_______ mol/L;
③最后,SO2的转化率由50%变为_______ %,NO2的转化率变为______ %。
C(s)+O2(g)═ CO2(g) △H═-393.5 kJ/mol
CO2(g)+C(s)═ 2CO(g) △H═+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:4Fe(s)+3O2(g)═ 2Fe2O3(s) △H═-648.42 kJ/mol
根据上面三个热化学方程式,回答下列问题:
①高炉内Fe2O3被CO还原为Fe的热化学方程式为
②炼制含铁96%的生铁时,实际生产中所需焦炭远高于理论用量,其原因是
(2)在10 L容器中,加入2 mol的SO2(g)和2 mol的NO2(g),保持温度恒定发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:①化学平衡将
②当达到新的平衡状态时,容器中SO2(g)的浓度是
③最后,SO2的转化率由50%变为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】常温下,有0.1 mol∙L−1的四种溶液:①NaOH ②Na2CO3 ③NaHSO4 ④NH4Cl
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因________________________
(2)溶液①中由水电离出的氢氧根浓度为________________
(3)溶液①、③等体积混合后,溶液中c(H+)________________ c(OH-)(填“>”、“<”或“=”)。
(4)溶液④中各离子浓度从大到小的顺序是_____________________________________
(5)反应A(g)+3B(g) 2C(g)在一定温度下达到平衡,该反应的平衡常数表达式
2C(g)在一定温度下达到平衡,该反应的平衡常数表达式_________________
(6)电解精炼铜的阳极为___________ ;铁钥匙上镀铜,镀件为________________ 极;
(7)为保护地下钢管不受腐蚀,可使它与直流电源的_______________ 极相连,该极发生__________ 反应(填“氧化”或“还原”)
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因
(2)溶液①中由水电离出的氢氧根浓度为
(3)溶液①、③等体积混合后,溶液中c(H+)
(4)溶液④中各离子浓度从大到小的顺序是
(5)反应A(g)+3B(g)
 2C(g)在一定温度下达到平衡,该反应的平衡常数表达式
2C(g)在一定温度下达到平衡,该反应的平衡常数表达式(6)电解精炼铜的阳极为
(7)为保护地下钢管不受腐蚀,可使它与直流电源的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示:

(1)A点水的离子积为1×10-14,B点水的离子积为__________ 。造成水的离子积变化的原因是__________________________________________________ 。
(2)25℃时,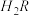 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:
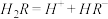 ,
,

 。
。
① 0.1 mol/L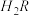 溶液的pH
溶液的pH________ 1(填“>”、“<”或“=”)。
②在0.1 mol/L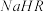 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:______________ 。
(3)100℃时,0.01 mol/L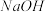 溶液的pH =
溶液的pH =____________ 。
(4)100℃时,将pH =8的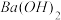 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则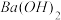 溶液与盐酸的体积比为
溶液与盐酸的体积比为___________ 。

(1)A点水的离子积为1×10-14,B点水的离子积为
(2)25℃时,
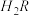 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: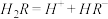 ,
,

 。
。① 0.1 mol/L
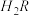 溶液的pH
溶液的pH②在0.1 mol/L
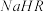 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:(3)100℃时,0.01 mol/L
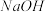 溶液的pH =
溶液的pH =(4)100℃时,将pH =8的
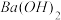 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则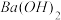 溶液与盐酸的体积比为
溶液与盐酸的体积比为
您最近一年使用:0次
【推荐3】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJ•mol-1)则上述反应的△H=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJ•mol-1)则上述反应的△H=______________ (用含a、b、c的代数式表示)kJ•mol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol•min-1)与催化剂的对应关系如表所示。
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________ (填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=______________ 。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________ (填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1mol•L-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
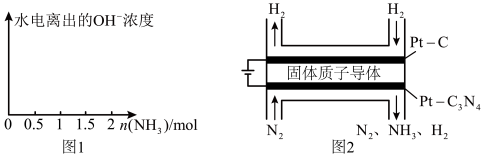
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________ 。
(1)氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJ•mol-1)则上述反应的△H=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJ•mol-1)则上述反应的△H=(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol•min-1)与催化剂的对应关系如表所示。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=(3)关于合成氨工艺的理解,下列说法不正确的是
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1mol•L-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。

(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂,可采用催化电解酸性食盐水的方法制备,装置如图甲。
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂,可采用催化电解酸性食盐水的方法制备,装置如图甲。
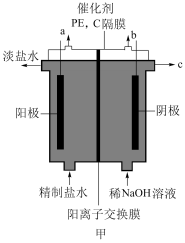
(1)产生 的电极反应为
的电极反应为_______ 。
(2) 消除苯酚等酚类物质污染的反应机理:
消除苯酚等酚类物质污染的反应机理: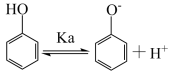
反应1: +ClO2→
+ClO2→ +
+ 速率常数为
速率常数为
反应2: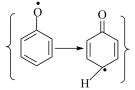 +ClO2→
+ClO2→ 速率常数为
速率常数为
已知反应速率常数: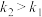 ,则决定
,则决定 与苯酚反应速率的步骤为反应
与苯酚反应速率的步骤为反应_______ (填“1”或“2”)。
(3)在电解食盐水时控制一定条件,会得到氯酸钠( )和氯化钠的混合液,已知二者溶解度曲线如图乙所示,则从二者混合液中提纯
)和氯化钠的混合液,已知二者溶解度曲线如图乙所示,则从二者混合液中提纯 的方法为
的方法为_______ 。

(4)商业上常用“有效氯”来说明含氯消毒剂的消毒能力,“有效氯”是指一定质量的消毒剂与多少质量的氯气氧化能力相当,其数值可用此时氯气的质量与消毒剂质量的百分比来表示,则 的“有效氯”数值约为,某100g“84”消毒液与3.55g氯气氧化能力相当,则该消毒液中含NaClO
的“有效氯”数值约为,某100g“84”消毒液与3.55g氯气氧化能力相当,则该消毒液中含NaClO_______ g(精确到小数点后两位)。
(5)25℃时配制0.1mol/L的氯水100mL(假设 完全溶解),用0.2mol/L的NaOH标准溶液进行滴定,滴定过程中溶液pH变化如图丙,则c、d、e三点所表示的溶液中水的电离程度最大的是
完全溶解),用0.2mol/L的NaOH标准溶液进行滴定,滴定过程中溶液pH变化如图丙,则c、d、e三点所表示的溶液中水的电离程度最大的是_______ ,d点溶液中的物料守恒为_______ ,滴定终点时消耗NaOH标准溶液100mL,此时pH=10.84,则该温度下 的水解平衡常数约为
的水解平衡常数约为_______ (已知 )。
)。

 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂,可采用催化电解酸性食盐水的方法制备,装置如图甲。
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂,可采用催化电解酸性食盐水的方法制备,装置如图甲。
(1)产生
 的电极反应为
的电极反应为(2)
 消除苯酚等酚类物质污染的反应机理:
消除苯酚等酚类物质污染的反应机理:
反应1:
 +ClO2→
+ClO2→ +
+ 速率常数为
速率常数为
反应2:
 +ClO2→
+ClO2→ 速率常数为
速率常数为
已知反应速率常数:
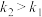 ,则决定
,则决定 与苯酚反应速率的步骤为反应
与苯酚反应速率的步骤为反应(3)在电解食盐水时控制一定条件,会得到氯酸钠(
 )和氯化钠的混合液,已知二者溶解度曲线如图乙所示,则从二者混合液中提纯
)和氯化钠的混合液,已知二者溶解度曲线如图乙所示,则从二者混合液中提纯 的方法为
的方法为
(4)商业上常用“有效氯”来说明含氯消毒剂的消毒能力,“有效氯”是指一定质量的消毒剂与多少质量的氯气氧化能力相当,其数值可用此时氯气的质量与消毒剂质量的百分比来表示,则
 的“有效氯”数值约为,某100g“84”消毒液与3.55g氯气氧化能力相当,则该消毒液中含NaClO
的“有效氯”数值约为,某100g“84”消毒液与3.55g氯气氧化能力相当,则该消毒液中含NaClO(5)25℃时配制0.1mol/L的氯水100mL(假设
 完全溶解),用0.2mol/L的NaOH标准溶液进行滴定,滴定过程中溶液pH变化如图丙,则c、d、e三点所表示的溶液中水的电离程度最大的是
完全溶解),用0.2mol/L的NaOH标准溶液进行滴定,滴定过程中溶液pH变化如图丙,则c、d、e三点所表示的溶液中水的电离程度最大的是 的水解平衡常数约为
的水解平衡常数约为 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室模拟拉希法用氨和次氯酸钠反应制备肼(N2H4),并探究肼的性质,制备装置如图所示。
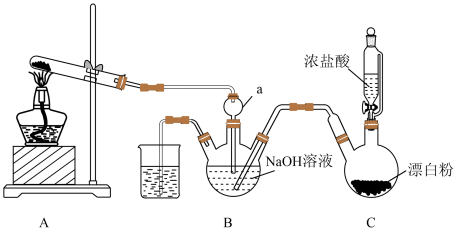
回答下列问题:
(1)肼的电子式为_______ 。
(2)装置A试管中的试剂为_______ 。
(3)装置B中制备肼的化学方程式为_______ 。
(4)上述装置中存在一处缺陷,会导致肼的产率降低,改进方法是_______ 。
(5)①探究性质。
已知N2H4是一种二元弱碱,在水中的电离与NH3相似,请写出肼的第二步电离的电离方程式:_______ ,室温下向N2H4水溶液中滴加某强酸,溶液的pH与 或
或 的变化关系如图所示,下列说法正确的是
的变化关系如图所示,下列说法正确的是_______ (填标号)。

A.N2H4在水溶液中第二步电离的平衡常数为10-1
B. 的平衡常数为109
的平衡常数为109
C.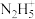 的水解能力大于其电离能力
的水解能力大于其电离能力
D.N2H6Cl2溶液中: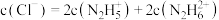
②测定产品中肼的质量分数。
称取装置B中溶液m g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH=6),加水配成100 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2~3滴指示剂,用c mol/L的碘标准溶液滴定,滴定过程中有无色无味无毒气体产生,定终点时平均消耗标准溶液V mL,产品中肼的质量分数为_______ (用含m、c、V的式子表示)。

回答下列问题:
(1)肼的电子式为
(2)装置A试管中的试剂为
(3)装置B中制备肼的化学方程式为
(4)上述装置中存在一处缺陷,会导致肼的产率降低,改进方法是
(5)①探究性质。
已知N2H4是一种二元弱碱,在水中的电离与NH3相似,请写出肼的第二步电离的电离方程式:
 或
或 的变化关系如图所示,下列说法正确的是
的变化关系如图所示,下列说法正确的是
A.N2H4在水溶液中第二步电离的平衡常数为10-1
B.
 的平衡常数为109
的平衡常数为109C.
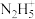 的水解能力大于其电离能力
的水解能力大于其电离能力D.N2H6Cl2溶液中:
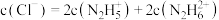
②测定产品中肼的质量分数。
称取装置B中溶液m g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH=6),加水配成100 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2~3滴指示剂,用c mol/L的碘标准溶液滴定,滴定过程中有无色无味无毒气体产生,定终点时平均消耗标准溶液V mL,产品中肼的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】乙二酸 俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
I.查阅资料可知,常温下,部分弱酸的电离平衡常数如下表:
(1)常温下, 的
的 溶液与
溶液与 的氢氟酸溶液等体积混合,溶液显
的氢氟酸溶液等体积混合,溶液显_______ 性(填“酸”“碱”或“中”)。
(2)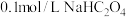 溶液中离子浓度大小关系
溶液中离子浓度大小关系_______ 。
(3) 溶液中通入过量的
溶液中通入过量的 ,反应的化学方程式为
,反应的化学方程式为_______ 。
II.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。人体缺乏维生素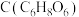 易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在
易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在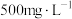 左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告。
左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告。
①测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然。
②测定原理: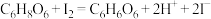 。
。
③实验用品及试剂:
a.仪器和用品(自选,说明:锥形瓶不易将液体溅出)
b.试剂:某品牌橙汁为 ,浓度为
,浓度为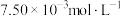 标准碘溶液、蒸馏水、指示剂
标准碘溶液、蒸馏水、指示剂
④实验过程:(略)
回答下列问题:
(4)用标准的碘溶液滴定待测的橙汁时,左手控制_______ 的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内颜色变化,当_______ 时到达滴定终点。
(5)下列操作中可能使所测橙汁的浓度偏低的是_______(填字母)。
(6)若经数据处理,滴定某品牌橙汁 (待测液)消耗标准碘溶液的体积是
(待测液)消耗标准碘溶液的体积是 ,从分析数据看,此品牌橙汁是否是纯天然橙汁?
,从分析数据看,此品牌橙汁是否是纯天然橙汁?_______ (填字母)(已知维生素C的摩尔质量为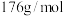 )。
)。
A.是 B.可能是 C.不是
 俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:I.查阅资料可知,常温下,部分弱酸的电离平衡常数如下表:
| 弱酸 |  |  |
| 电离平衡常数 | 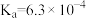 | 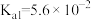 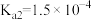 |
 的
的 溶液与
溶液与 的氢氟酸溶液等体积混合,溶液显
的氢氟酸溶液等体积混合,溶液显(2)
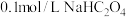 溶液中离子浓度大小关系
溶液中离子浓度大小关系(3)
 溶液中通入过量的
溶液中通入过量的 ,反应的化学方程式为
,反应的化学方程式为II.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。人体缺乏维生素
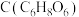 易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在
易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在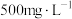 左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告。
左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告。①测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然。
②测定原理:
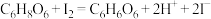 。
。③实验用品及试剂:
a.仪器和用品(自选,说明:锥形瓶不易将液体溅出)
b.试剂:某品牌橙汁为
 ,浓度为
,浓度为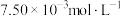 标准碘溶液、蒸馏水、指示剂
标准碘溶液、蒸馏水、指示剂④实验过程:(略)
回答下列问题:
(4)用标准的碘溶液滴定待测的橙汁时,左手控制
(5)下列操作中可能使所测橙汁的浓度偏低的是_______(填字母)。
| A.酸式滴定管未用标准碘液润洗就直接注入标准碘液 |
| B.滴定前盛放待测液溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取碘液体积时,开始仰视读数,滴定结束时俯视读数 |
 (待测液)消耗标准碘溶液的体积是
(待测液)消耗标准碘溶液的体积是 ,从分析数据看,此品牌橙汁是否是纯天然橙汁?
,从分析数据看,此品牌橙汁是否是纯天然橙汁?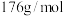 )。
)。A.是 B.可能是 C.不是
您最近一年使用:0次



