C、Si、S和N元素在化学中占有极其重要的地位。
(1)写出Si的基态原子价电子排布式______ 。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______ 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______ ,微粒间存在的作用力是______ 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是______ 。
(4)SO2、NO2、H2S同属于______ 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是______ 。
(1)写出Si的基态原子价电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是
(4)SO2、NO2、H2S同属于
2012·陕西·一模 查看更多[1]
(已下线)2012届陕西省西工大附中高三第11次模拟考试理综化学试卷
更新时间:2016-12-08 19:16:00
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子占有的原子轨道数为______ 个,P、S、Cl的第一电离能由大到小顺序为_______ 。
(2)PCl3分子中的中心原子杂化轨道类型是______ ,该分子构型为_______ 。
(3)PH4Cl的电子式为______ ,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为________ 。
⑷已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO___ NiO(填“>”、“<”或“=”),理由是______ 。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______ 。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为____ g。(用a、NA表示)
(1)基态Cl原子核外电子占有的原子轨道数为
(2)PCl3分子中的中心原子杂化轨道类型是
(3)PH4Cl的电子式为
⑷已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO
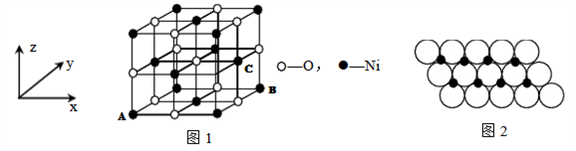
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1) A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。C和D反应可生成组成比为1∶3 的化合物E,E的立体构型为____ ,中心原子的杂化轨道类型为____ 。化合物D2A的立体构型为____ ,中心原子的价层电子对数为 ____ 。
(2)X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。利用价层电子对互斥理论判断TU3的立体构型是___ 。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___ ,其中氧原子的杂化方式为___ 。
(2)X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。利用价层电子对互斥理论判断TU3的立体构型是
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________ 。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC:TiO2+3C TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________ ;根据所给信息,可知TiC是________ 晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________ 晶体,其空间构型为正四面体,则钛原子的杂化方式为__________ 。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________ 、__________ 。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:
该氧化物的化学式为________ ;在晶胞中Ti原子的配位数为_______ ,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________ g/cm3。
(1)Ti的基态原子的电子排布式为
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC:TiO2+3C
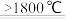 TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:
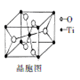
该氧化物的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】磷酸亚铁锂( )可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 、
、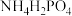 等作为原料制备。请回答下列问题:
等作为原料制备。请回答下列问题:
(1)P在元素周期表中的位置为___________ 。
(2)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ ,基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为___________ 。
(3)基态 原子的核外电子有
原子的核外电子有___________ 种空间运动状态,其能量最高的电子的电子云轮廓图为___________ 。
(4)组成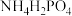 ,的非金属元素中,N、P、O的电负性由大到小的顺序为
,的非金属元素中,N、P、O的电负性由大到小的顺序为___________ (填元素符号);第一电离能:N___________ (填“>”或“<”)O,原因是___________ 。
 )可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 、
、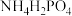 等作为原料制备。请回答下列问题:
等作为原料制备。请回答下列问题:(1)P在元素周期表中的位置为
(2)基态
 原子的价层电子排布式为
原子的价层电子排布式为 与
与 中未成对的电子数之比为
中未成对的电子数之比为(3)基态
 原子的核外电子有
原子的核外电子有(4)组成
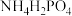 ,的非金属元素中,N、P、O的电负性由大到小的顺序为
,的非金属元素中,N、P、O的电负性由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是___________________ (用<连接)。
(2)基态Cu原子的核外电子排布式为______________________ 。
(3)用价层电子对互斥理论判断SO3的模型为________ ,NF 3 分子的空间构型为__________ 。
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是
(2)基态Cu原子的核外电子排布式为
(3)用价层电子对互斥理论判断SO3的模型为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸钴结合成络台物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是______ ,基态硫原子的价电子排布式为_______ 。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为_______ (填化学式),1mol/LCN-中含有的π键的数目为_________ 。
(3)血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______ (填元素符号)
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为
(3)血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)晶体的自范性即__________ ,区分晶体与非晶体最可靠的实验方法是________ ;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是__________ ,Π键的特征是__________ 。
(3)Li2O是离子晶体,其晶格能可通过下图的Born−Haber循环计算得到。

可知,Li原子的第一电离能为__________ kJ/mol,O=O键键能为______ kJ/mol,Li2O的晶格能为_________ kJ/mol。
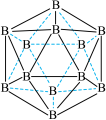
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_______ 个硼原子组成,共含有__________ 个B−B键。

(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是
(3)Li2O是离子晶体,其晶格能可通过下图的Born−Haber循环计算得到。

可知,Li原子的第一电离能为
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式___________ 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是___________ ;
②写出Al2Cl6分子的结构式___________ ;
③单分子A1Cl3的立体构型是___________ ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是___________ 。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有___________ 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)___________ ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=___________ pm。
(1)写出基态镓原子的电子排布式
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是
②写出Al2Cl6分子的结构式
③单分子A1Cl3的立体构型是
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的四种常见元素,基态X原子核外有2个未成对电子,基态Z原子最外层电子排布式为nsnnpn+2,W的核电荷数等于X与Y的核电荷数之和的2倍。
(1)Z在元素周期表中的位置为________ ,W的元素基态原子的电子排布式是________ 。
(2)X、Y、Z三种元素的第一电离能的大小顺序为________ (用元素符号表示,下同);H-X、 H-Y、H-Z三种共价键中,键长最长的是_________ 。
(3)Y的最简单氢化物的空间构型是_________ 。
(4)CH3+、—CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是________ 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(1)Z在元素周期表中的位置为
(2)X、Y、Z三种元素的第一电离能的大小顺序为
(3)Y的最简单氢化物的空间构型是
(4)CH3+、—CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。

(1)石墨的硬度小、熔沸点高的原因分别是____ 。
(2)如图晶体的化学式为____ 。

(1)石墨的硬度小、熔沸点高的原因分别是
(2)如图晶体的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______ 。
(2)写出与H2O分子互为等电子体的微粒________________ (填2种)。
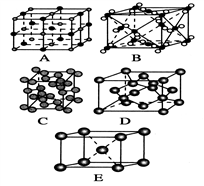
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。其中E图堆积方式的空间利用率为_________ ,与冰的晶体类型相同的是________ (请用相应的编号填写)
(4)高温下,超氧化钾(KO2)晶体呈立方体结构,其晶胞结构与NaCl的相同,则每个晶胞中含有___ 个K+和___ 个O2— ;晶体中K+ 的配位数为___ ,O2— 的配位数为______ 。
(5)60 g 金刚石中的共价键数为_________ 个,60g SiO2晶体中的共价键数为_______ 个。
(1)水分子中氧原子在基态时核外电子排布式为
(2)写出与H2O分子互为等电子体的微粒
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。其中E图堆积方式的空间利用率为

(4)高温下,超氧化钾(KO2)晶体呈立方体结构,其晶胞结构与NaCl的相同,则每个晶胞中含有
(5)60 g 金刚石中的共价键数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________ ,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________ 。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________ ,H3BO3晶体中硼原子个数与极性键个数比为________ 。
(3)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用________ 理论。
(4)三种晶体中熔点最低的是________ ,其晶体受热熔化时,克服的微粒之间的相互作用为______ 。

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是
(3)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用
(4)三种晶体中熔点最低的是
您最近一年使用:0次



