为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
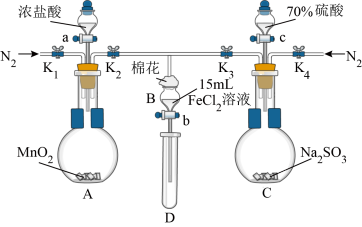
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________ 。
(2)棉花中浸润的溶液为_______________________ 。
(3)A中发生反应的化学方程式为______________________________ 。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2 > Fe3+ >SO2的是____________________ (填“甲”“乙”“丙”)。
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) + (aq)
(aq) FeSO3(s)(墨绿色)。
FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
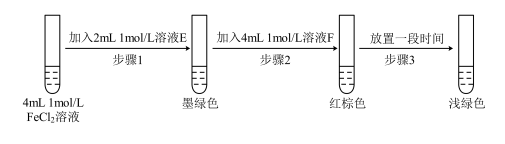
①溶液E化学式为_________ ,溶液F化学式为___________ 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因____________ 。

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式为
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2 > Fe3+ >SO2的是
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有 |
| 乙 | 既有Fe3+又有Fe2+ | 有 |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 (aq)
(aq) FeSO3(s)(墨绿色)。
FeSO3(s)(墨绿色)。提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:

①溶液E化学式为
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因
更新时间:2020-10-19 01:18:09
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室制备Cl2和新制Cl2水,如图所示:
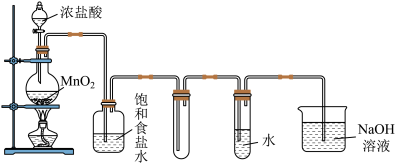
根据上述实验过程,回答下列问题:
(1)实验开始前,应先进行的操作是________________________ 。
(2)装置中盛装浓盐酸的仪器名称是_________________ ,装置中若无盛饱和食盐水的洗气瓶,将导致____________________ 。
(3)要证明Cl2与水反应是可逆反应,则证明氯水存在Cl2分子的现象是_____ ,证明同时存在HCl和HClO的实验操作及现象是________________________ 。
(4)吸收Cl2尾气的化学反应方程式为________________________ 。
(5)向装有新制氯水的试管中加入适量KBr溶液,反应的化学方程式为:________________________ ,待充分反应后,再加入四氯化碳并振荡,观察到的现象是__________________________________ 。
(6)有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是_______ 。

根据上述实验过程,回答下列问题:
(1)实验开始前,应先进行的操作是
(2)装置中盛装浓盐酸的仪器名称是
(3)要证明Cl2与水反应是可逆反应,则证明氯水存在Cl2分子的现象是
(4)吸收Cl2尾气的化学反应方程式为
(5)向装有新制氯水的试管中加入适量KBr溶液,反应的化学方程式为:
(6)有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水 遇潮湿空气即产生大量白雾),可用下列装置制备。
遇潮湿空气即产生大量白雾),可用下列装置制备。
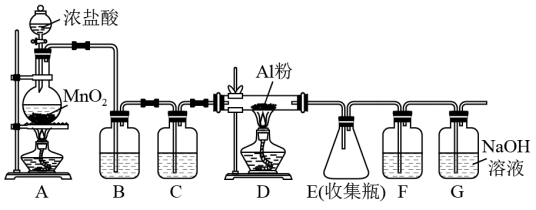
(1)装置B中盛放_______ 溶液,其作用是_______ ;F中的是_______ 溶液,其作用是_______ 。
(2)装置A实验开始前,应先_______ ,接下来的操作依次是_______ (填序号)。
A.往烧瓶中加入 粉末 B.加热 C.往烧瓶中加入浓盐酸
粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 生成;
生成; 沸点为
沸点为 ,熔点为
,熔点为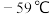 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。
,液态为黄绿色。
①设计最简单的实验验证 中含有
中含有 :收集一试管气体,盖上胶塞,放入冰水混合物中,若
:收集一试管气体,盖上胶塞,放入冰水混合物中,若_______ ,则证明 中含有
中含有 。
。
②将过硫酸钠 溶液加入亚氯酸钠
溶液加入亚氯酸钠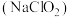 中可制备
中可制备 ,
,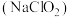 中
中 元素的化合价是
元素的化合价是_______ ,该反应中氧化剂和还原剂的物质的量之比为_______ 。(已知:过硫酸钠 反应后产物为
反应后产物为 )
)
(4)G中发生的化学反应方程式为_______ 。
 遇潮湿空气即产生大量白雾),可用下列装置制备。
遇潮湿空气即产生大量白雾),可用下列装置制备。
(1)装置B中盛放
(2)装置A实验开始前,应先
A.往烧瓶中加入
 粉末 B.加热 C.往烧瓶中加入浓盐酸
粉末 B.加热 C.往烧瓶中加入浓盐酸(3)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量
 生成;
生成; 沸点为
沸点为 ,熔点为
,熔点为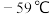 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。
,液态为黄绿色。①设计最简单的实验验证
 中含有
中含有 :收集一试管气体,盖上胶塞,放入冰水混合物中,若
:收集一试管气体,盖上胶塞,放入冰水混合物中,若 中含有
中含有 。
。②将过硫酸钠
 溶液加入亚氯酸钠
溶液加入亚氯酸钠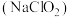 中可制备
中可制备 ,
,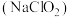 中
中 元素的化合价是
元素的化合价是 反应后产物为
反应后产物为 )
)(4)G中发生的化学反应方程式为
您最近一年使用:0次
【推荐3】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是___________ ,请写出该反应相应的化学方程式___________ 。
(2)装置B中饱和食盐水的作用是___________ ,同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是___________ (填字母编号)。
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到E中溶液分为两层,上层(苯层)为紫红色,下层为无色,该现象___________ (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是___________ 。
(5)装置F的作用是___________ ,其烧杯中的溶液不能选用下列中的___________ 。
A.饱和NaOH溶液B.饱和Ca(OH)2溶液C.饱和Na2SO3溶液D.饱和Na2CO3溶液
(6)若向100mLFeBr2若液中通入2.24LCl2(标准状况下),若溶液中有 的Br-被氧化成单质Br2,则原FeBr2的物质的量浓度为
的Br-被氧化成单质Br2,则原FeBr2的物质的量浓度为___________ 。(已知溴水能把Fe2+氧化为Fe3+)

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是
A.饱和NaOH溶液B.饱和Ca(OH)2溶液C.饱和Na2SO3溶液D.饱和Na2CO3溶液
(6)若向100mLFeBr2若液中通入2.24LCl2(标准状况下),若溶液中有
 的Br-被氧化成单质Br2,则原FeBr2的物质的量浓度为
的Br-被氧化成单质Br2,则原FeBr2的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】葡萄酒等果酒易发生变质,常加入抗氧化剂。如图是一种抗氧化剂的制取装置。实验前已除尽装置内的空气,实验后装置Ⅱ中有Na2S2O5晶体析出。

(1)实验前除尽装置内空气的原因是___ 。
(2)装置Ⅰ中的玻璃仪器的名称___ 。
(3)要从装置Ⅱ中获得纯净的晶体,操作方法是___ 。
(4)下列可用于装置Ⅲ的为___ (填序号)。

(5)设计实验证明Na2S2O5晶体在空气中可能被氧化,实验方案是___ 。

(1)实验前除尽装置内空气的原因是
(2)装置Ⅰ中的玻璃仪器的名称
(3)要从装置Ⅱ中获得纯净的晶体,操作方法是
(4)下列可用于装置Ⅲ的为

(5)设计实验证明Na2S2O5晶体在空气中可能被氧化,实验方案是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】POCl3是重要的基础化工原料,广泛用于制药、染料、表面活性剂等行业。一种制备POCl3的原理为: PCl3+Cl2+SO2=POCl3+SOCl2。某化学学习小组拟利用如图装置在实验室模拟制备POCl3。

有关物质性质如下:
(1)装置C的作用是________ 。
(2)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为____ (写名称)。若无该装置,则可能会有什么后果?请用化学方程式进行说明_______ 。
(3)D中反应温度控制在60~65℃,其原因是_______ 。
(4)测定POCl3含量。
①准确称取30.70g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00 mL 3.200 mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+为指示剂,用0.2000 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mLKSCN溶液。
ⅰ滴定终点的现象为___________ 。
ⅱ 反应中POCl3的百分含量为__________ 。

有关物质性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 |
| PCl3 | -93.6 | 76.1 | 1.574 | 遇水强烈水解,易与氧气反应 |
| POCl3 | 1.25 | 105.8 | 1.645 | 遇水强烈水解,能溶于PCl3 |
| SOCl2 | -105 | 78.8 | 1.638 | 遇水强烈水解,加热易分解 |
(2)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为
(3)D中反应温度控制在60~65℃,其原因是
(4)测定POCl3含量。
①准确称取30.70g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00 mL 3.200 mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+为指示剂,用0.2000 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mLKSCN溶液。
ⅰ滴定终点的现象为
ⅱ 反应中POCl3的百分含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】 是一种重要化合物,食品中添加
是一种重要化合物,食品中添加 可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行
可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行 与
与 溶液反应相关实验(夹持装置已略去)。
溶液反应相关实验(夹持装置已略去)。
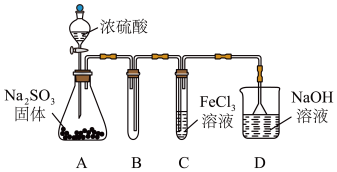
(1)盛放浓硫酸的装置名称是___________ ,D中倒置漏斗的作用___________ 。
(2)装置A中发生的化学反应方程式为___________ 。
(3)根据C中溶液由棕黄色变成浅绿色的现象,该小组同学认为 与
与 溶液发生氧化还原反应。写出
溶液发生氧化还原反应。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(4)该小组同学向C试管反应后的溶液中加入硝酸酸化的 溶液,若出现白色沉淀,即可证明反应生成了
溶液,若出现白色沉淀,即可证明反应生成了 。该做法
。该做法___________ (填“合理”或“不合理”),理由是___________ 。
(5)为了验证SO2具有还原性,实验中不可以代替 溶液的试剂有___________(填字母)。
溶液的试剂有___________(填字母)。
 是一种重要化合物,食品中添加
是一种重要化合物,食品中添加 可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行
可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行 与
与 溶液反应相关实验(夹持装置已略去)。
溶液反应相关实验(夹持装置已略去)。
(1)盛放浓硫酸的装置名称是
(2)装置A中发生的化学反应方程式为
(3)根据C中溶液由棕黄色变成浅绿色的现象,该小组同学认为
 与
与 溶液发生氧化还原反应。写出
溶液发生氧化还原反应。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式(4)该小组同学向C试管反应后的溶液中加入硝酸酸化的
 溶液,若出现白色沉淀,即可证明反应生成了
溶液,若出现白色沉淀,即可证明反应生成了 。该做法
。该做法(5)为了验证SO2具有还原性,实验中不可以代替
 溶液的试剂有___________(填字母)。
溶液的试剂有___________(填字母)。| A.浓硫酸 | B.酸性 溶液 溶液 | C.氯水 | D.品红溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示为两个实验装置(铁架台等辅助仪器已略去)。

回答下列问题:
(1)实验甲在加热过程中能观察到有白色沉淀生成的是_______ (填“Ⅰ”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是_______ ,通过实验甲可比较出_______ (填“Na2CO3”或“NaHCO3”)较稳定。请写出分解的化学方程式_______ 。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花燃烧。写出Na2O2与CO2发生反应的化学方程式_______ ,棉花燃烧说明该反应的特点是_______ 。

回答下列问题:
(1)实验甲在加热过程中能观察到有白色沉淀生成的是
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花燃烧。写出Na2O2与CO2发生反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】为确认 、
、 、
、 的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
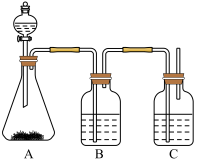
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为________ 。
(2)装置B所盛的试剂是_____________ ,其作用是__________________ 。
(3)装置C所盛试剂是________________ ,C中反应的离子方程式是____________ 。
(4)由此得到的结论是酸性:________ >________ >________ 。
 、
、 、
、 的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为
(2)装置B所盛的试剂是
(3)装置C所盛试剂是
(4)由此得到的结论是酸性:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】室温下,某同学进行CO2 与Na2O2反应的探究实验,回答下列问题。
(1)用下图装置制备纯净的CO2

①丙装置的名称是__________ ,乙、丙装置中盛装的试剂分别是__________ 、_________ 。
②若CO2中混有HCl,则HCl 与Na2O2反应的化学方程式为_____________ 。
(2)按照下面的装置图进行实验(夹持装置略)。

①先组装仪器,然后_____________ ,再用注射器1 抽取100 mL 纯净的CO2,将其连接在K1处,注射器2 的活塞推到底后连接在K2处,具支U 形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1 的活塞,可观察到的现象是_________ 。
③实验过程中,需缓慢推入CO2,其目的是_____________ ,为达到相同目的,还可进行的操作是_____________ 。
(3)实验结束后,当注射器1 的活塞推到底时,测得注射器2 中气体体积为65 mL,则CO2的转化率是_________ 。
(1)用下图装置制备纯净的CO2

①丙装置的名称是
②若CO2中混有HCl,则HCl 与Na2O2反应的化学方程式为
(2)按照下面的装置图进行实验(夹持装置略)。

①先组装仪器,然后
②打开止水夹K1、K2,向右推动注射器1 的活塞,可观察到的现象是
③实验过程中,需缓慢推入CO2,其目的是
(3)实验结束后,当注射器1 的活塞推到底时,测得注射器2 中气体体积为65 mL,则CO2的转化率是
您最近一年使用:0次



