元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)当皮肤划破时可用FeCl3溶液应急止血,用氯化铁固体配制成450 mL 0.1mol·L-1的溶液,配制过程中所需要的玻璃仪器有量筒、玻璃棒、烧杯、______________ 。
(2)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子______________ (填离子符号)。
(3)高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。其工业制备反Fe(OH)3+ClO-+OH-→FeO +Cl-+H2O(未配平),每生成1 mol K2FeO4,转移的电子数
+Cl-+H2O(未配平),每生成1 mol K2FeO4,转移的电子数________ NA。
(4) 要将纯碱高温熔化,下列坩埚中可选用的是___________ .
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚.
(5)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO 、Cl-、SO
、Cl-、SO 中的4种离子,且均为1 mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是
中的4种离子,且均为1 mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是____________ 。
(1)当皮肤划破时可用FeCl3溶液应急止血,用氯化铁固体配制成450 mL 0.1mol·L-1的溶液,配制过程中所需要的玻璃仪器有量筒、玻璃棒、烧杯、
(2)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子
(3)高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。其工业制备反Fe(OH)3+ClO-+OH-→FeO
 +Cl-+H2O(未配平),每生成1 mol K2FeO4,转移的电子数
+Cl-+H2O(未配平),每生成1 mol K2FeO4,转移的电子数(4) 要将纯碱高温熔化,下列坩埚中可选用的是
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚.
(5)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO
 、Cl-、SO
、Cl-、SO 中的4种离子,且均为1 mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是
中的4种离子,且均为1 mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是
更新时间:2020-10-31 08:23:14
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
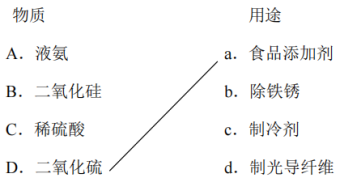
【推荐1】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

注:氢化物指的是由氢元素和另一种元素组成的化合物, CH4就是碳元素的一种氢化物。
(1)X的化学式为_______ 。
(2)已知SO3是一种酸性氧化物,请写出SO3与NaOH溶液反应的离子方程式为_______ 。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______ (填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4 d.SO2 + Na2SO4
(4)将X与Y混合,可生成硫单质。该反应的氧化剂与还原剂的个数之比为_______ 。

注:氢化物指的是由氢元素和另一种元素组成的化合物, CH4就是碳元素的一种氢化物。
(1)X的化学式为
(2)已知SO3是一种酸性氧化物,请写出SO3与NaOH溶液反应的离子方程式为
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4 d.SO2 + Na2SO4
(4)将X与Y混合,可生成硫单质。该反应的氧化剂与还原剂的个数之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】I.下列各组化学反应中,盐酸均是反应物。
(1)利用盐酸的氧化性的是(填编号,下同)_______ ;
(2)仅利用盐酸的还原性的是_______ ;
(3)仅利用盐酸的酸性的是_______ ,既利用还原性又利用酸性的是_______ 。
①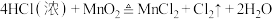
②
③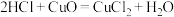
④
⑤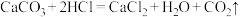
II.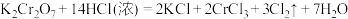
(4)_______ 是氧化剂;_______ 是还原产物。
(5)在参加反应的盐酸中,起还原剂(被氧化)作用的 与起酸性作用的
与起酸性作用的 的质量比为
的质量比为_______ 。
(6)用双线桥法标明电子转移的方向和数目:_______ 。
(1)利用盐酸的氧化性的是(填编号,下同)
(2)仅利用盐酸的还原性的是
(3)仅利用盐酸的酸性的是
①
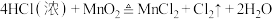
②

③
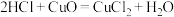
④

⑤
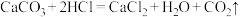
II.
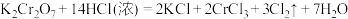
(4)
(5)在参加反应的盐酸中,起还原剂(被氧化)作用的
 与起酸性作用的
与起酸性作用的 的质量比为
的质量比为(6)用双线桥法标明电子转移的方向和数目:
您最近一年使用:0次
【推荐3】(1)在S2-、Fe3+、Fe2+、Mg2+、S、I-、H+中,只有氧化性的是___ ,只有还原性的是__ ,既有氧化性又有还原性的是__ 。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O②NH3+NO→HNO2+H2O③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是___ (填序号)。
(3)下列三个氧化还原反应中,氧化性最强的物质是___ (填化学式)。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(4)用双线桥标出下列反应中电子转移的方向和数目:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O___ 。该反应中氧化产物是___ 。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O②NH3+NO→HNO2+H2O③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是
(3)下列三个氧化还原反应中,氧化性最强的物质是
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(4)用双线桥标出下列反应中电子转移的方向和数目:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)写出石英的化学式_______ ;
(2)写出实验室制备NH3的化学方程式_______ ;
(3)实验室盛放碱溶液的试剂应用橡胶塞,不能用玻璃塞,用化学方程式解释原因_______ 。
(4)将0.6mol硫化亚铜跟硝酸反应,生成硝酸铜、一氧化氮、硫和水,在参加反应的硝酸中,未被还原的硝酸是_______ 摩尔。
(2)写出实验室制备NH3的化学方程式
(3)实验室盛放碱溶液的试剂应用橡胶塞,不能用玻璃塞,用化学方程式解释原因
(4)将0.6mol硫化亚铜跟硝酸反应,生成硝酸铜、一氧化氮、硫和水,在参加反应的硝酸中,未被还原的硝酸是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求回答下列问题:
(1)FeCl3 溶液和 Fe(OH)3 胶体的本质区别是:_____________ 。
(2)工业上制玻璃的原料有纯碱、石英和_____________ (填名称)。
(3)工业上金属钠可用来制备钛等金属,利用了金属钠的____________ 性。
(4)盛放 NaOH 溶液的玻璃试剂瓶应选用____________ 塞(填“玻璃”或“橡胶”)。
(5)用四氯化碳萃取溴水后,分液时有机层从分液漏斗的_____________ (填“下口放出”或“上口倒出”)。
(6)6.20 g Na2O 晶体中含离子数目是_____________ (NA为阿伏伽德罗常数的数值)。
(7)等质量的 NH3 和 H2S 中,氢原子的个数比是_________ 。
(8)加热某碱式碳酸镁晶体[4MgCO3∙Mg(OH)2∙5H2O]至质量不再变化时,得到 10.0g 残留固体和__________ L CO2(标准状况下)。
(1)FeCl3 溶液和 Fe(OH)3 胶体的本质区别是:
(2)工业上制玻璃的原料有纯碱、石英和
(3)工业上金属钠可用来制备钛等金属,利用了金属钠的
(4)盛放 NaOH 溶液的玻璃试剂瓶应选用
(5)用四氯化碳萃取溴水后,分液时有机层从分液漏斗的
(6)6.20 g Na2O 晶体中含离子数目是
(7)等质量的 NH3 和 H2S 中,氢原子的个数比是
(8)加热某碱式碳酸镁晶体[4MgCO3∙Mg(OH)2∙5H2O]至质量不再变化时,得到 10.0g 残留固体和
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】实验室要配制100mL 0.5mol·L-1的NaOH溶液,试回答下列各题:
(1)若用NaOH固体配制溶液,下列仪器中,肯定不会用到的是___________
A.锥形瓶 B.200 mL容量瓶 C.烧杯 D.胶头滴管 E.药匙 F天平 G、洗瓶
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品______________ 。
(3)容量瓶上除有刻度线外还应标有__________________ ,在使用前必须检查容量瓶是否_______________ 。
(4)配制过程有以下操作:
A、移液 B、称量 C、洗涤 D、定容 E、溶解 F、摇匀
其正确的操作顺序应是______________ (填序号)。
(5)下列四项错误操作会导致所得溶液的浓度偏高的是__________________
A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
B.配制溶液所用的容量瓶洗净后没有烘干
C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内进行后续操作
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F.定容摇匀后静置,发现液面低于刻度线,再加蒸馏水至刻度线。
(1)若用NaOH固体配制溶液,下列仪器中,肯定不会用到的是
A.锥形瓶 B.200 mL容量瓶 C.烧杯 D.胶头滴管 E.药匙 F天平 G、洗瓶
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品
(3)容量瓶上除有刻度线外还应标有
(4)配制过程有以下操作:
A、移液 B、称量 C、洗涤 D、定容 E、溶解 F、摇匀
其正确的操作顺序应是
(5)下列四项错误操作会导致所得溶液的浓度偏高的是
A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
B.配制溶液所用的容量瓶洗净后没有烘干
C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内进行后续操作
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F.定容摇匀后静置,发现液面低于刻度线,再加蒸馏水至刻度线。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如图实验室某浓度盐酸试剂瓶上的标签,根据有关数据回答下列问题。
(1)该浓盐酸的物质的量浓度为___________ mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L的盐酸。
①该学生需要量取___________ mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)___________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶、振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿着杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿着玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线2~3cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质量浓度有何影响?(填偏高或偏低或无影响)
I.用量筒量取浓盐酸时俯视液面___________
II.用量筒量取浓盐酸后,洗涤量筒,洗涤液也转移到容量瓶中___________
III.溶液注入容量瓶前没有恢复到室温就进行定容___________
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.2g/cm3 HCl质量分数:36.5% |
(1)该浓盐酸的物质的量浓度为
(2)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L的盐酸。
①该学生需要量取
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶、振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿着杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿着玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线2~3cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质量浓度有何影响?(填偏高或偏低或无影响)
I.用量筒量取浓盐酸时俯视液面
II.用量筒量取浓盐酸后,洗涤量筒,洗涤液也转移到容量瓶中
III.溶液注入容量瓶前没有恢复到室温就进行定容
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)在标准状况下,①6.72 L CH4气体;②3.01×1023个 HCl气体分子;③13.6 g H2S气体;④0.2 mol NH3,下列对这四种气体所含分子物质的量的关系从小到大的排列是(用上述数字序号表示)______ 。
(2)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要的仪器名称为(写出三种)______ 。
②该同学将所得精盐配成溶液,用于另一实验:实验中需要用60 mL 2 mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为______ ,该同学将精盐放在天平的右盘中称量好后,配制成溶液,则该溶液的浓度______ 2 mol·L-1(填“>”、“<”或“=”)。
(2)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要的仪器名称为(写出三种)
②该同学将所得精盐配成溶液,用于另一实验:实验中需要用60 mL 2 mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生的反应为2NO+2CO=N2+2CO2。
(1)碳元素的化合价___________ (填“升高”或“降低”),被___________ (填“氧化”或“还原”),CO是___________ 剂(填“氧化”或“还原”),NO是___________ 剂(填“氧化”或“还原”),发生___________ 反应(填“氧化”或“还原”)。
(2)用单线桥表示此反应中的电子转移情况2NO+2CO=N2+2CO2:___________ 。
(3)若反应中消耗了2molCO,则生成N2的物质的量为___________ mol,转移电子的物质的量为___________ mol。
(4)H2S与CO2在高温下反应可生成氧硫化碳(COS),氧硫化碳分子中所有原子均满足最外层8电子稳定结构,其结构式为___________ 。
(1)碳元素的化合价
(2)用单线桥表示此反应中的电子转移情况2NO+2CO=N2+2CO2:
(3)若反应中消耗了2molCO,则生成N2的物质的量为
(4)H2S与CO2在高温下反应可生成氧硫化碳(COS),氧硫化碳分子中所有原子均满足最外层8电子稳定结构,其结构式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙的骄傲。黑火药在发生爆炸时,发生如下反应: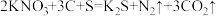 。其中被氧化的元素是
。其中被氧化的元素是___ ,还原产物是___ 。
(2) 与浓
与浓 发生反应:
发生反应: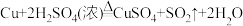 。其中氧化产物为
。其中氧化产物为___ 。若反应中转移电子的物质的量为 ,则生成的
,则生成的 气体在标准状况下的体积
气体在标准状况下的体积__ 。
(3)下列微粒:①S② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ 在化学反应中只能被氧化的是
在化学反应中只能被氧化的是___ (填序号,下同),只能表现出氧化性的是____ 。
(4)配平化学方程式: +
+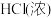 =
= +
+ +
+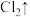 +
+ ,
,___ ,上述反应中物质氧化性:___ >__ ,每生成 时有
时有__ 个电子发生转移,氧化剂与还原剂的物质的量之比为___ 。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙的骄傲。黑火药在发生爆炸时,发生如下反应:
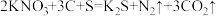 。其中被氧化的元素是
。其中被氧化的元素是(2)
 与浓
与浓 发生反应:
发生反应: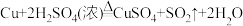 。其中氧化产物为
。其中氧化产物为 ,则生成的
,则生成的 气体在标准状况下的体积
气体在标准状况下的体积(3)下列微粒:①S②
 ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ 在化学反应中只能被氧化的是
在化学反应中只能被氧化的是(4)配平化学方程式:
 +
+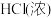 =
= +
+ +
+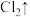 +
+ ,
, 时有
时有
您最近一年使用:0次



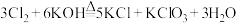
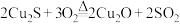
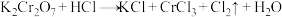 (未配平)
(未配平)


