高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
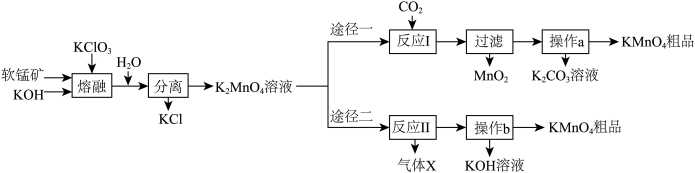
已知:
(1)KClO3、软锰矿和KOH熔融的化学方程式为____________ ;
(2)整个流程中可以循环利用的物质有__________ ;
(3)反应I中,氧化产物与还原产物的物质的量之比为_______ ;
(4)反应I中,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是___________ ;
(5)反应Ⅱ的条件为电解,气体X是_______ 。(写化学式)
(6)途径一、二中的操作a、b相同,均包括___________ 、___________ 、过滤等3步。
(7)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al等杂质元素)制备高纯碳酸锰的实验过程如下:

其中除杂过程包括:首先向浸出液中加入一定量的Y,调节浸出液的pH为3.5~5.5;再加入一定量的软锰矿和双氧水,过滤除去Fe(OH)3、Al(OH)3;
①试剂Y可以是__________ (填出一种即可);
②浸出时加入植物粉的作用是___________ ;
③写出“沉淀”过程中产生碳酸锰的离子方程式___________ 。
④取100 kg软锰矿(含MnO2量为87%),最后获取高纯MnCO3的(纯度为99%)质量为92 kg,则该流程中高纯MnCO3的产率为______ 。

已知:
| 温度 | 溶解度/g | |||
| K2CO3 | KHCO3 | KMnO4 | KOH | |
| 20℃ | 111 | 33.7 | 6.38 | 112 |
(2)整个流程中可以循环利用的物质有
(3)反应I中,氧化产物与还原产物的物质的量之比为
(4)反应I中,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是
(5)反应Ⅱ的条件为电解,气体X是
(6)途径一、二中的操作a、b相同,均包括
(7)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al等杂质元素)制备高纯碳酸锰的实验过程如下:

其中除杂过程包括:首先向浸出液中加入一定量的Y,调节浸出液的pH为3.5~5.5;再加入一定量的软锰矿和双氧水,过滤除去Fe(OH)3、Al(OH)3;
①试剂Y可以是
②浸出时加入植物粉的作用是
③写出“沉淀”过程中产生碳酸锰的离子方程式
④取100 kg软锰矿(含MnO2量为87%),最后获取高纯MnCO3的(纯度为99%)质量为92 kg,则该流程中高纯MnCO3的产率为
更新时间:2020-11-16 22:57:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】硫氰化钾( )是一种重要的无机物,主要用于合成树脂、杀虫杀菌剂等,也是检验
)是一种重要的无机物,主要用于合成树脂、杀虫杀菌剂等,也是检验 的常用指示剂。实验室模拟工业制备硫氰化钾(
的常用指示剂。实验室模拟工业制备硫氰化钾( )实验装置如图:
)实验装置如图:
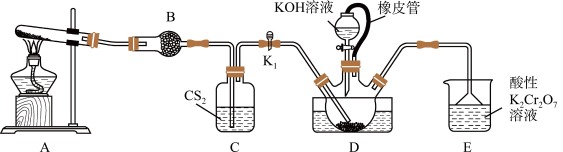
已知: 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 。
。
(1)制备 溶液:三颈烧瓶内盛放有
溶液:三颈烧瓶内盛放有 、水和催化剂,实验开始时,打开
、水和催化剂,实验开始时,打开 (
( 处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至
处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至 消失,反应的方程式为:
消失,反应的方程式为: 。
。
①装置A中发生反应的化学方程式为__________________ 。
②装置B的仪器名称是_________ 。装置D中橡皮管的作用是_________ 。
③ 不仅作为反应物参加反应,其作用还有
不仅作为反应物参加反应,其作用还有_________ 、_________ 。
(2)制备 溶液:
溶液:
熄灭A处的酒精灯,关闭 ,移开水浴,将装置D继续加热至105℃,
,移开水浴,将装置D继续加热至105℃, 完全分解后(反应方程式为
完全分解后(反应方程式为 ),打开
),打开 ,继续保持溶液温度为105℃,缓缓滴入适量的
,继续保持溶液温度为105℃,缓缓滴入适量的 溶液,制得
溶液,制得 溶液。反应的化学方程式为
溶液。反应的化学方程式为___________________________ 。
(3)制备 晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、
晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、_________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)酸性 溶液可吸收
溶液可吸收 分解产生的两种气体,溶液中出现淡黄色的浑浊,写出生成淡黄色浑浊的离子方程式
分解产生的两种气体,溶液中出现淡黄色的浑浊,写出生成淡黄色浑浊的离子方程式__________________ 。
 )是一种重要的无机物,主要用于合成树脂、杀虫杀菌剂等,也是检验
)是一种重要的无机物,主要用于合成树脂、杀虫杀菌剂等,也是检验 的常用指示剂。实验室模拟工业制备硫氰化钾(
的常用指示剂。实验室模拟工业制备硫氰化钾( )实验装置如图:
)实验装置如图:
已知:
 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 。
。(1)制备
 溶液:三颈烧瓶内盛放有
溶液:三颈烧瓶内盛放有 、水和催化剂,实验开始时,打开
、水和催化剂,实验开始时,打开 (
( 处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至
处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至 消失,反应的方程式为:
消失,反应的方程式为: 。
。①装置A中发生反应的化学方程式为
②装置B的仪器名称是
③
 不仅作为反应物参加反应,其作用还有
不仅作为反应物参加反应,其作用还有(2)制备
 溶液:
溶液:熄灭A处的酒精灯,关闭
 ,移开水浴,将装置D继续加热至105℃,
,移开水浴,将装置D继续加热至105℃, 完全分解后(反应方程式为
完全分解后(反应方程式为 ),打开
),打开 ,继续保持溶液温度为105℃,缓缓滴入适量的
,继续保持溶液温度为105℃,缓缓滴入适量的 溶液,制得
溶液,制得 溶液。反应的化学方程式为
溶液。反应的化学方程式为(3)制备
 晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、
晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、(4)酸性
 溶液可吸收
溶液可吸收 分解产生的两种气体,溶液中出现淡黄色的浑浊,写出生成淡黄色浑浊的离子方程式
分解产生的两种气体,溶液中出现淡黄色的浑浊,写出生成淡黄色浑浊的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】含氮化合物对环境、生产和人类活动有很大影响。
(1)氨气具有还原性。将氨气通入灼热的氧化铜固体中,现象是_______________________ ;化学方程式是_______________________________________________________ 。
(2)NF3为无色、无味的气体,在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为___________ ,NF3在空气中泄漏时很容易被观察到,原因是__________________________________________________________________ 。
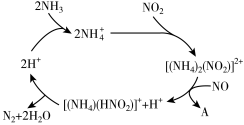
(3)利用某分子筛作催化剂,可脱除工厂废气中的NO、NO2,反应机理如图所示。请写出脱去NO的离子反应方程式:_______________________________________________________ 。
(4)火箭燃料偏二甲肼C2H8N2与N2O4反应放出大量的热,生成无毒、无污染的气体和水。1 mol C2H8N2完全反应转移的电子数是___________ 。
(1)氨气具有还原性。将氨气通入灼热的氧化铜固体中,现象是
(2)NF3为无色、无味的气体,在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为
(3)利用某分子筛作催化剂,可脱除工厂废气中的NO、NO2,反应机理如图所示。请写出脱去NO的离子反应方程式:

(4)火箭燃料偏二甲肼C2H8N2与N2O4反应放出大量的热,生成无毒、无污染的气体和水。1 mol C2H8N2完全反应转移的电子数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氧钒(IV)碱式碳酸铵晶体难溶于水,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以V2O5为原料制备氧钒(IV)碱式碳酸铵晶体,过程如图:
V2O5 VOCl2溶液
VOCl2溶液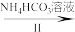 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
已知:①氧化性:V2O5>Cl2;②VO2+能被O2氧化。
(1)步骤I不选用盐酸,而选用盐酸一盐酸肼(HCl—N2H4·2HCl),可以防止生成____ ,保护环境。
(2)步骤II可在如图装置中进行:

①上述装置依次连接的合理顺序为c→____ (按气流方向,用小写字母表示)。
②连接好装置,检查气密性良好后,加入试剂,开始实验,先____ (填实验操作),当C中溶液变浑浊,____ (填实验操作),进行实验。
③装置D中每生成1mol氧钒(IV)碱式碳酸铵晶体,需要消耗____ molNH4HCO3。
(3)加入VOCl2溶液使反应完全,取下恒压滴液漏斗,立即塞上橡胶塞,将三颈烧瓶置于CO2保护下的干燥器中,静置,得到紫色晶体,过滤。接下来的操作是____ ,最后用乙醚洗涤2-3次,干燥后称重。(必须用到的药品为:饱和NH4HCO3溶液,无水乙醇)。
(4)测定粗产品中钒的含量。实验步骤如下:
称量ag产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为bmL。NaNO2溶液的作用是____ (用离子方程式表示),粗产品中钒的质量分数表达式为____ (以VO2+计)。若(NH4)2Fe(SO4)2标准溶液部分变质,则测定结果____ (填“偏高”、“偏低”或“无影响”)。已知:VO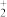 +Fe2++2H+=VO2++Fe3++H2O。
+Fe2++2H+=VO2++Fe3++H2O。
V2O5
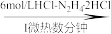 VOCl2溶液
VOCl2溶液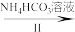 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O已知:①氧化性:V2O5>Cl2;②VO2+能被O2氧化。
(1)步骤I不选用盐酸,而选用盐酸一盐酸肼(HCl—N2H4·2HCl),可以防止生成
(2)步骤II可在如图装置中进行:

①上述装置依次连接的合理顺序为c→
②连接好装置,检查气密性良好后,加入试剂,开始实验,先
③装置D中每生成1mol氧钒(IV)碱式碳酸铵晶体,需要消耗
(3)加入VOCl2溶液使反应完全,取下恒压滴液漏斗,立即塞上橡胶塞,将三颈烧瓶置于CO2保护下的干燥器中,静置,得到紫色晶体,过滤。接下来的操作是
(4)测定粗产品中钒的含量。实验步骤如下:
称量ag产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为bmL。NaNO2溶液的作用是
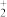 +Fe2++2H+=VO2++Fe3++H2O。
+Fe2++2H+=VO2++Fe3++H2O。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图甲、乙所示的装置进行实验,回答下列问题。
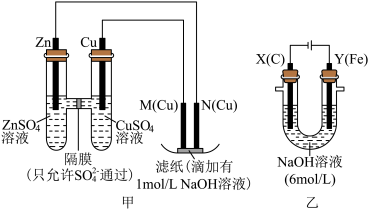
Ⅰ.用甲装置进行第一组实验:
(1)甲中电子的流向正确的是_____ (填序号)。
A.由Cu流向M,M流向N,N流向Zn
B.由Cu沿导线流向M,由N沿导线流向Zn
C.由Zn沿导线流向N,由M沿导线流向Cu
(2)在保证电极反应不变的情况下,下列材料能代替硫酸铜溶液中Cu电极的是_____(填序号)。
(3)实验过程中,甲池左侧的 浓度
浓度_____ (填“增大”或“减小”),滤纸上能观察到的现象是_____ 。
Ⅱ.该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根离子( )在溶液中呈紫红色。请根据实验现象及资料信息,填写下列空白:
)在溶液中呈紫红色。请根据实验现象及资料信息,填写下列空白:
(4)可用碱性甲烷燃料电池作为乙池的外加电源,写出该燃料电池负极的电极反应式_____ 。
(5)电解过程中,X极附近溶液的碱性_____ (填“增强”“减弱”或“不变”)。
(6)电解过程中,Y极发生的电极反应为 和
和_____ 。

Ⅰ.用甲装置进行第一组实验:
(1)甲中电子的流向正确的是
A.由Cu流向M,M流向N,N流向Zn
B.由Cu沿导线流向M,由N沿导线流向Zn
C.由Zn沿导线流向N,由M沿导线流向Cu
(2)在保证电极反应不变的情况下,下列材料能代替硫酸铜溶液中Cu电极的是_____(填序号)。
| A.石墨 | B.铂 | C.铝 | D.镁 |
 浓度
浓度Ⅱ.该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根离子(
 )在溶液中呈紫红色。请根据实验现象及资料信息,填写下列空白:
)在溶液中呈紫红色。请根据实验现象及资料信息,填写下列空白:(4)可用碱性甲烷燃料电池作为乙池的外加电源,写出该燃料电池负极的电极反应式
(5)电解过程中,X极附近溶液的碱性
(6)电解过程中,Y极发生的电极反应为
 和
和
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:

(1)通入甲烷的铂电极上发生的电极反应式为_______ 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为_______ L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为_______ 。
(3)若要用此装置在铁片上镀银,则:
①M电极的材料是_______ ,(“铁片”“银片”“石墨”中选填)电极反应式为_______ ;N电极的材料是_______ ,(“铁片”“银片”“石墨”中选填)电解质溶液是_______ 。
②若M、N极质量相同, 电镀进行一段时间后,当两极质量相差2.16g时,外电路共通过电子的物质的量是_______ mol。

(1)通入甲烷的铂电极上发生的电极反应式为
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为
(3)若要用此装置在铁片上镀银,则:
①M电极的材料是
②若M、N极质量相同, 电镀进行一段时间后,当两极质量相差2.16g时,外电路共通过电子的物质的量是
您最近一年使用:0次
【推荐3】纯碱是人们生活的必需品和重要的化工原料。我国化学家侯德榜开创了侯德榜制碱法,解决了20世纪初我国的用碱问题。
I.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和 等杂质,为提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释____________ 。
(2)“趁热过滤”时的温度应控制在____________ 。
II.电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如图所示

在阳极区发生的反应包括____________ 。阳离子交换膜允许____________ 通过。物质B是____________ (填化学式),作用为____________ 。
I.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和
 等杂质,为提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释
(2)“趁热过滤”时的温度应控制在
II.电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如图所示

在阳极区发生的反应包括
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】霞石是一种硅酸盐,其组成可表示为K2O·3Na2O·4Al2O3·8SiO2,某小组同学设计以霞石为原料制备Al2O3的方案如下:

请回答下列问题:
(1)沉淀1的化学式为______________________________________________ 。
(2)滤液1与过量NaOH溶液反应的所有的离子方程式为____________ 。
(3)写出由溶液2生成Al(OH)3的离子方程式:_______________________ 。
(4)通入过量的CO2,过滤后的滤液中含有的阴离子主要是________ 。
(5)由Al(OH)3→Al2O3的反应条件为_________________________________ 。

请回答下列问题:
(1)沉淀1的化学式为
(2)滤液1与过量NaOH溶液反应的所有的离子方程式为
(3)写出由溶液2生成Al(OH)3的离子方程式:
(4)通入过量的CO2,过滤后的滤液中含有的阴离子主要是
(5)由Al(OH)3→Al2O3的反应条件为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】 是重要化工原料,由软锰矿制备
是重要化工原料,由软锰矿制备 的一种工艺流程如下:
的一种工艺流程如下:

资料:
①软锰矿的主要成分为 ,主要杂质有
,主要杂质有 和
和 。
。
②金属离子沉淀的
③该工艺条件下, 与
与 不反应。
不反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是_________________________________ 。
②溶出时, 的氧化过程及得到
的氧化过程及得到 的主要途径如图所示。
的主要途径如图所示。

i.II是从软锰矿中溶出 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是___________ 。
i.若 全部来自于反应
全部来自于反应 ,完全溶出
,完全溶出 所需
所需 与
与 的物质的量比值为2。而实际比值(0.9)小于2,原因是
的物质的量比值为2。而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知: 的氧化性与溶液
的氧化性与溶液 有关。纯化时先加入
有关。纯化时先加入 ,后加入
,后加入 ,调溶液
,调溶液 说明试剂加入顺序及调节
说明试剂加入顺序及调节 的原因:
的原因:______________________ 。
(3)产品纯度测定
向 产品中依次加入足量
产品中依次加入足量 和足量稀
和足量稀 ,加热至充分反应,再用
,加热至充分反应,再用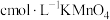 溶液滴定剩余
溶液滴定剩余 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 .(已知:
.(已知: 及
及 均被还原为
均被还原为 .相对分子质量:
.相对分子质量: ;
; )
)
产品纯度为______________________ (用质量分数表示)。
 是重要化工原料,由软锰矿制备
是重要化工原料,由软锰矿制备 的一种工艺流程如下:
的一种工艺流程如下:
资料:
①软锰矿的主要成分为
 ,主要杂质有
,主要杂质有 和
和 。
。②金属离子沉淀的

|
|
|
| |
开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
 与
与 不反应。
不反应。(1)溶出
①溶出前,软锰矿需研磨。目的是
②溶出时,
 的氧化过程及得到
的氧化过程及得到 的主要途径如图所示。
的主要途径如图所示。
i.II是从软锰矿中溶出
 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是i.若
 全部来自于反应
全部来自于反应 ,完全溶出
,完全溶出 所需
所需 与
与 的物质的量比值为2。而实际比值(0.9)小于2,原因是
的物质的量比值为2。而实际比值(0.9)小于2,原因是(2)纯化
已知:
 的氧化性与溶液
的氧化性与溶液 有关。纯化时先加入
有关。纯化时先加入 ,后加入
,后加入 ,调溶液
,调溶液 说明试剂加入顺序及调节
说明试剂加入顺序及调节 的原因:
的原因:(3)产品纯度测定
向
 产品中依次加入足量
产品中依次加入足量 和足量稀
和足量稀 ,加热至充分反应,再用
,加热至充分反应,再用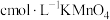 溶液滴定剩余
溶液滴定剩余 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 .(已知:
.(已知: 及
及 均被还原为
均被还原为 .相对分子质量:
.相对分子质量: ;
; )
)产品纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。提示:图中A代表沉淀或者溶液

(1)检验提纯后的KCl中是否还含有SO42-的方法是____________________________ 。
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,回答下列问题:
①根据计算,所需称量的KCl的质量为__________ 。
②容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的______ 。(填数字符号)
③下列操作会使所配溶液浓度偏低的是__________ (填选项代号)。
A.配制前容量瓶内壁刻度线以下存有水珠 B.没有洗涤烧杯内壁
C.转移溶液时部分溶液溅出容量瓶外 D.定容时俯视
(3)试剂Ⅰ的名称为______ ,试剂Ⅱ的化学式为______ ,试剂Ⅲ的化学式为_____ 。

(1)检验提纯后的KCl中是否还含有SO42-的方法是
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,回答下列问题:
①根据计算,所需称量的KCl的质量为
②容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的
③下列操作会使所配溶液浓度偏低的是
A.配制前容量瓶内壁刻度线以下存有水珠 B.没有洗涤烧杯内壁
C.转移溶液时部分溶液溅出容量瓶外 D.定容时俯视
(3)试剂Ⅰ的名称为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
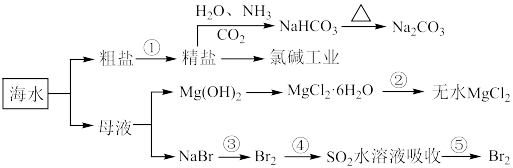
(1)海水淡化的方法还有___________ (写出一种)。
(2)步骤②的具体操作是___________ 。
(3)精盐制备NaHCO3的过程中通入NH3和CO2的顺序是___________ 。
(4)电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的化学方程式___________ 。
(5)步骤④SO2的吸收液也可以用Na2CO3溶液代替,已知Na2CO3溶液吸收Br2可生成NaBrO3,请写出的离子反应方程式___________ 。
(6)由海水提炼出的精制盐往往含有碘元素。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取ag食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
已知:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①KIO3与KI在酸性条件下发生反应的化学方程式为___________ 。
②b中反应所产生的I2的物质的量是___________ 。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)___________ mg/kg。

(1)海水淡化的方法还有
(2)步骤②的具体操作是
(3)精盐制备NaHCO3的过程中通入NH3和CO2的顺序是
(4)电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的化学方程式
(5)步骤④SO2的吸收液也可以用Na2CO3溶液代替,已知Na2CO3溶液吸收Br2可生成NaBrO3,请写出的离子反应方程式
(6)由海水提炼出的精制盐往往含有碘元素。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取ag食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。①KIO3与KI在酸性条件下发生反应的化学方程式为
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色。
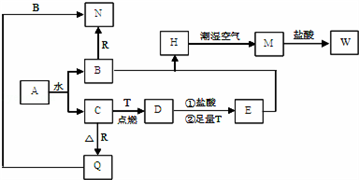
(1)写出下列物质的化学式:D______ N_______
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:_______ ; H在潮湿空气中变成M的过程中发生的化学方程式为:___________________ 。
(3)按要求写方程式: B和R反应生成N的离子方程式:______________________ 。M→W的离子方程式:____________________ 。

(1)写出下列物质的化学式:D
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:
(3)按要求写方程式: B和R反应生成N的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】二苯甲烷( )有定香能力,用于配制香水。在一定温度下,二苯甲烷可通过苯和氯化苄(
)有定香能力,用于配制香水。在一定温度下,二苯甲烷可通过苯和氯化苄(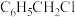 )在
)在 催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知:
催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知: 易水解和升华。
易水解和升华。
I.制备
(1)利用如图装置制备 时进行操作:
时进行操作:
②向硬质玻璃管中加入Al粉;
③通入 ;
;
④加热。
操作①为_______ ,该装置存在一处明显的缺陷是_______ 。
(2)装置中A的作用为_______ 。
(3)硬质玻璃管直接连接C装置的优点是_______ 。
II.合成二苯甲烷
步骤①:如图向三颈烧瓶中加入39.0mL苯( )、46.0mL氯化苄(
)、46.0mL氯化苄( )和适量
)和适量 ,控制温度为80℃左右,持续2h;
,控制温度为80℃左右,持续2h;
(4)仪器G的名称_______ ,其作用为_______ 。操作b为_______ 。
(5)苯和氯化苄合成二苯甲烷的化学方程式为_______ 。
(6)若分离所得二苯甲烷的质量为50.4g,则其产率为_______ (保留两位有效数字)。
 )有定香能力,用于配制香水。在一定温度下,二苯甲烷可通过苯和氯化苄(
)有定香能力,用于配制香水。在一定温度下,二苯甲烷可通过苯和氯化苄(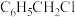 )在
)在 催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知:
催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知: 易水解和升华。
易水解和升华。I.制备

(1)利用如图装置制备
 时进行操作:
时进行操作:
②向硬质玻璃管中加入Al粉;
③通入
 ;
;④加热。
操作①为
(2)装置中A的作用为
(3)硬质玻璃管直接连接C装置的优点是
II.合成二苯甲烷
步骤①:如图向三颈烧瓶中加入39.0mL苯(
 )、46.0mL氯化苄(
)、46.0mL氯化苄( )和适量
)和适量 ,控制温度为80℃左右,持续2h;
,控制温度为80℃左右,持续2h;
(4)仪器G的名称
(5)苯和氯化苄合成二苯甲烷的化学方程式为
(6)若分离所得二苯甲烷的质量为50.4g,则其产率为
您最近一年使用:0次




