水体中植物营养素过多蓄积会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
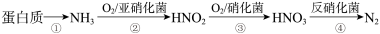
请回答
(1)造成水体富营养化的元素有氮元素和_____ (填字母)。
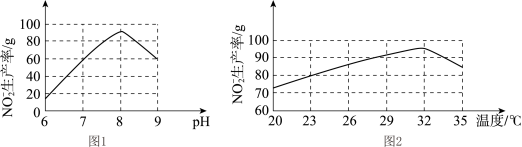
(2)根据图1和图2,推断使用亚硝化菌的最佳条件为_____ 。
(3)过程③,发生化合反应的化学方程式为_____
(4)利用微生物处理含氮废水的优点为_____
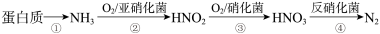
请回答
(1)造成水体富营养化的元素有氮元素和
a.磷元素 b.氧元素
(2)根据图1和图2,推断使用亚硝化菌的最佳条件为

(3)过程③,发生化合反应的化学方程式为
(4)利用微生物处理含氮废水的优点为
更新时间:2020-11-17 20:06:51
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______ (填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式:
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________

已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是
(2)滤渣的成分是
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是
(4)①配平反应的离子方程式:

②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol/L) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2等)为原料制备Ni(OH)2的工艺流程如图:
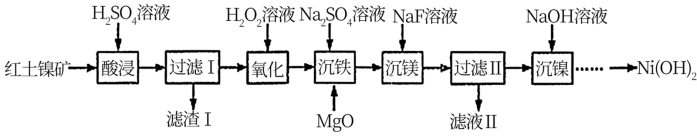
(1)“酸浸”时,加快化学反应速率的措施___ (写一条即可)。滤渣1的成分为___ (填化学式)。
(2)“氧化”时,Fe2+发生反应的离子方程式为___ ,若用NaClO代替H2O2溶液,使0.1molFe2+转化为Fe3+,则需NaClO至少为___ mol。
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是___ 。
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___ 。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是___ 。室温时,若“沉镍”后的滤液c(Ni2+)<1×10-5mol•L-1,则滤液中pH>___ 。(Ksp[Ni(OH)2=1×10-15)

(1)“酸浸”时,加快化学反应速率的措施
(2)“氧化”时,Fe2+发生反应的离子方程式为
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是
| 金属离子 | Fe2+ | Fe3+ | Mg2+ | Ni2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 8.9 | 6.9 |
| 沉淀完全的pH | 8.3 | 2.8 | 10.9 | 8.9 |
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高纯氧化镁广泛用作高温耐热材料,在陶瓷领域中用作透光性陶瓷坩埚、基板等的原料,在电气材料、电气领域中用作磁性装置填料、绝缘材料填料及各种载体。利用蛇纹石矿粉[镁质层状硅酸盐矿物,主要成分为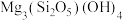 ,杂质为
,杂质为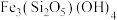 、
、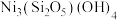 ]制备高纯氧化镁的工艺流程如图,请回答下列问题:
]制备高纯氧化镁的工艺流程如图,请回答下列问题:
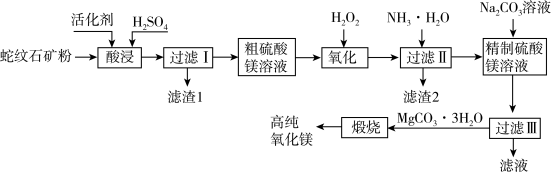
已知:①蛇纹石矿粉在适宜条件下会与硫酸溶液反应,矿石中镁等可溶性成分进入溶液,主要反应的化学方程式为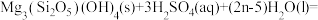
 。
。
②相关金属离子沉淀的pH(常温下,溶液中的离子浓度小于或等于 时可认为沉淀完全,100.8取6.3)如下:
时可认为沉淀完全,100.8取6.3)如下:
(1)将蛇纹矿石制成矿粉的目的是_______ 。
(2)写出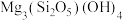 以氧化物表示的组成形式:
以氧化物表示的组成形式:_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)“氧化”过程中加入 的目的是
的目的是_______ (用离子方程式表示)。加入 后用
后用 调节溶液的
调节溶液的 的范围为
的范围为_______ 。请结合表中数据计算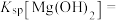
_______ 。
(5)向精制硫酸镁溶液中加入一定浓度的碳酸钠溶液可使镁离子沉淀。写出该过程的化学方程式:_______ 。
(6)过滤后,需要洗涤沉淀,请简述检验沉淀是否洗涤干净的操作:_______ 。
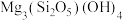 ,杂质为
,杂质为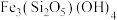 、
、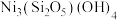 ]制备高纯氧化镁的工艺流程如图,请回答下列问题:
]制备高纯氧化镁的工艺流程如图,请回答下列问题: 
已知:①蛇纹石矿粉在适宜条件下会与硫酸溶液反应,矿石中镁等可溶性成分进入溶液,主要反应的化学方程式为
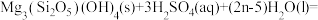
 。
。②相关金属离子沉淀的pH(常温下,溶液中的离子浓度小于或等于
 时可认为沉淀完全,100.8取6.3)如下:
时可认为沉淀完全,100.8取6.3)如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.6 | 6.5 | 6.7 | 9.4 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 | 10.9 |
(2)写出
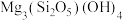 以氧化物表示的组成形式:
以氧化物表示的组成形式:(3)“滤渣1”的主要成分为
(4)“氧化”过程中加入
 的目的是
的目的是 后用
后用 调节溶液的
调节溶液的 的范围为
的范围为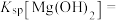
(5)向精制硫酸镁溶液中加入一定浓度的碳酸钠溶液可使镁离子沉淀。写出该过程的化学方程式:
(6)过滤后,需要洗涤沉淀,请简述检验沉淀是否洗涤干净的操作:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氮是自然界中生物体生命活动不可缺少的重要元素,其化合物种类丰富。
Ⅰ.氨是重要的化工原料,实验室可通过图1装置制取。
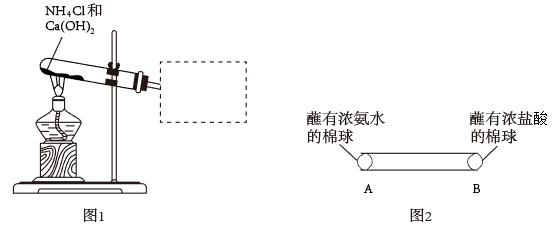
(1)写出实验室制取NH3的化学方程式___________ 。
(2)请将图l方框中用试管 收集NH3的装置补充完整___________ 。
(3)图2中,玻璃管内可观察到的现象是___________ (已知:相同条件下,相对分子质量小的气体,运动速率较快)。
(4)图2中,反应的生成物溶于水得到溶液a。取溶液a少许于试管中,___________ (填:操作和现象),则证明溶液a含有 。
。
II.研究氮的循环和转化对生产、生活有重要的价值。某工厂制硝酸的流程如下图所示。
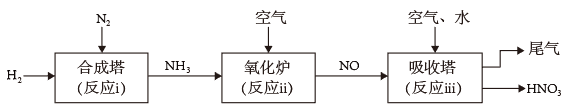
(5)上述转化中,属于氮的固定的是___________ (填“i”“ii”或“iii”)。
(6)写出“氧化炉”中反应的化学方程式___________ 。
(7)“吸收塔”排出的尾气中会含有NO、NO2等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。纯碱溶液与NO2反应的原理如下,请将该化学方程式补充完整:Na2CO3 + 2NO2 = NaNO3 +___________ + CO2
Ⅰ.氨是重要的化工原料,实验室可通过图1装置制取。

(1)写出实验室制取NH3的化学方程式
(2)请将图l方框中用
(3)图2中,玻璃管内可观察到的现象是
(4)图2中,反应的生成物溶于水得到溶液a。取溶液a少许于试管中,
 。
。II.研究氮的循环和转化对生产、生活有重要的价值。某工厂制硝酸的流程如下图所示。

(5)上述转化中,属于氮的固定的是
(6)写出“氧化炉”中反应的化学方程式
(7)“吸收塔”排出的尾气中会含有NO、NO2等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。纯碱溶液与NO2反应的原理如下,请将该化学方程式补充完整:Na2CO3 + 2NO2 = NaNO3 +
您最近一年使用:0次
【推荐2】(1)下列各组物质属于同素异形体________ ;属于同位素是________ ;属于同一种物质是________ ;属于同系物是________ 。(写序号)
①红磷与白磷;②12C与14C;③S2与S8;④235U与238U;⑤干冰与二氧化碳;⑥CH4与CH3CH3;⑦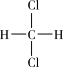 与
与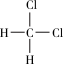 ;⑧CH3CH=CH2和CH2=CH2。
;⑧CH3CH=CH2和CH2=CH2。
(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,请写出工业上用A制备酒精的化学方程式________ 。
(3)在一定体积的 18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为 0.9 mol。则浓硫酸的实际体积________ (填“大于”“小于”或“等于”)100 mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如 KNO3溶液),则该反应的离子方程式_________ 。
①红磷与白磷;②12C与14C;③S2与S8;④235U与238U;⑤干冰与二氧化碳;⑥CH4与CH3CH3;⑦
 与
与 ;⑧CH3CH=CH2和CH2=CH2。
;⑧CH3CH=CH2和CH2=CH2。(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,请写出工业上用A制备酒精的化学方程式
(3)在一定体积的 18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为 0.9 mol。则浓硫酸的实际体积
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某学习小组在实验室研究 与
与 溶液的反应。
溶液的反应。
Ⅰ.[制备二氧化硫]
(1)实验室常用亚硫酸钠固体与浓硫酸反应制取二氧化硫。
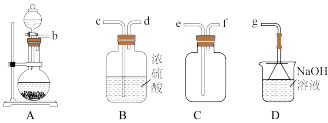
①写出该反应的化学方程式_______ 。
②欲制取并收集干燥的二氧化硫,选择下图中的装置,其最佳连接顺序为_______ 。(按气流方向,用大写字母表示,部分装置可重复使用)。
Ⅱ.[实验探究]
向盛有 溶液的试管中,缓慢通入
溶液的试管中,缓慢通入 气体,试管内有白色沉淀产生。
气体,试管内有白色沉淀产生。
(2)预测白色沉淀可能是_______ 。
(3)配制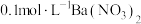 溶液时所用蒸馏水必须加热煮沸,目的是
溶液时所用蒸馏水必须加热煮沸,目的是_______ 。
将 分别通入无氧、有氧且浓度均为
分别通入无氧、有氧且浓度均为 的
的 溶液和
溶液和 溶液中,探究
溶液中,探究 和
和 哪种微粒起到了主要氧化作用,实验记录如下:
哪种微粒起到了主要氧化作用,实验记录如下:
(4)曲线a所示溶液 降低的原因
降低的原因_______ (用化学方程式表示)。
(5)曲线c所示溶液中发生反应的离子方程式为_______ 。
(6)曲线d_______ (填“能”或“不能”)说明 是氧化
是氧化 的主要微粒。
的主要微粒。
 与
与 溶液的反应。
溶液的反应。Ⅰ.[制备二氧化硫]
(1)实验室常用亚硫酸钠固体与浓硫酸反应制取二氧化硫。

①写出该反应的化学方程式
②欲制取并收集干燥的二氧化硫,选择下图中的装置,其最佳连接顺序为
Ⅱ.[实验探究]
向盛有
 溶液的试管中,缓慢通入
溶液的试管中,缓慢通入 气体,试管内有白色沉淀产生。
气体,试管内有白色沉淀产生。(2)预测白色沉淀可能是
(3)配制
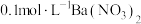 溶液时所用蒸馏水必须加热煮沸,目的是
溶液时所用蒸馏水必须加热煮沸,目的是将
 分别通入无氧、有氧且浓度均为
分别通入无氧、有氧且浓度均为 的
的 溶液和
溶液和 溶液中,探究
溶液中,探究 和
和 哪种微粒起到了主要氧化作用,实验记录如下:
哪种微粒起到了主要氧化作用,实验记录如下:| 项目 | 实验记录 |
 变化 变化 | 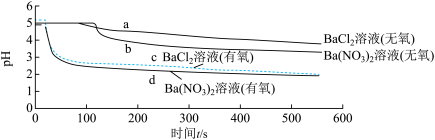 |
| 是否产生沉淀 |  溶液(无氧)中无白色沉淀、 溶液(无氧)中无白色沉淀、 溶液(有氧)中有白色沉淀、 溶液(有氧)中有白色沉淀、 溶液(无氧)中有白色沉淀、 溶液(无氧)中有白色沉淀、 溶液(有氧)中有白色沉淀。 溶液(有氧)中有白色沉淀。 |
 降低的原因
降低的原因(5)曲线c所示溶液中发生反应的离子方程式为
(6)曲线d
 是氧化
是氧化 的主要微粒。
的主要微粒。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】最近小明对水产生了浓厚的兴趣。

(1)在化学课堂上,老师进行了电解水的实验,揭示了水的组成。右图实验中试管1中得到的气体在点燃之前要先进行验纯的原因是_____ 。
(2)小明放学回家后,主动帮妈妈刷碗,发现自来水洗不掉碗碟上的油污,发现加入少许洗涤剂就可以洗干净,是因为洗涤剂有_____ 作用。
(3)周末他取村子里的河水于玻璃杯中,倒入少量肥皂水,用筷子搅拌后发现有大量浮渣漂浮在水面上,无泡沫产生,说明河水是_____ (选填“硬水”或“软水”)。硬水的危害很大,生活中将硬水软化的方法是_____ 。
(4)晚上,小明在电视上看到保护水资源的呼吁。下列做法中,你认为有利于防治水体污染的是_____。
(5)小明从课本学习到水常用作溶剂,实验室配制质量分数为0.9%的氯化钠溶液,小明用量筒量取蒸馏水读数时,仰视凹液面的最低处,会引起所配溶液的溶质质量分数_____ (选填“大于”、“小于”或“等于”)0.9%。

(1)在化学课堂上,老师进行了电解水的实验,揭示了水的组成。右图实验中试管1中得到的气体在点燃之前要先进行验纯的原因是
(2)小明放学回家后,主动帮妈妈刷碗,发现自来水洗不掉碗碟上的油污,发现加入少许洗涤剂就可以洗干净,是因为洗涤剂有
(3)周末他取村子里的河水于玻璃杯中,倒入少量肥皂水,用筷子搅拌后发现有大量浮渣漂浮在水面上,无泡沫产生,说明河水是
(4)晚上,小明在电视上看到保护水资源的呼吁。下列做法中,你认为有利于防治水体污染的是_____。
| A.使用节水型马桶 | B.生活污水任意排放 |
| C.合理施用农药和化肥 | D.工业废水处理达标后排放 |
(5)小明从课本学习到水常用作溶剂,实验室配制质量分数为0.9%的氯化钠溶液,小明用量筒量取蒸馏水读数时,仰视凹液面的最低处,会引起所配溶液的溶质质量分数
您最近一年使用:0次
【推荐1】化工废料铬渣非法丢放,容易导致严重的水污染,某地因铬渣污染,水体污泥中含有Cr3+,回收再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+):

(1)实验室用质量分数为98%,密度为1.84g/mL的浓硫酸配制250mL 3.68mol•L-1的硫酸溶液,需要用量筒量取浓硫酸_________ mL;
(2)H2O2的电子式为_________ ;
(3)设计简单实验方案分离滤渣2中的2种化学成分,最佳试剂为NaOH溶液和_________ ;
(4)通过钠离子交换树脂,所除杂质离子对应元素在周期表中的族序数是_________ ;
(5)通入SO2过程发生反应的化学方程式为_________ ;
(6)也可用Fe做电极,利用电解法将Na2Cr2O7转化为Cr(OH)3沉淀,同时有Fe(OH)3沉淀生成,整个过程所涉及到总反应的离子方程式为_________ ,若电解过程中电流强度为I,处理1mol Na2Cr2O7理论上需要时间为_________ (已知一个电子的电量为q,NA表示阿伏加德罗常数),研究发现当Na2Cr2O7浓度较大时三价铁能够全部沉淀,而部分三价铬以某种形式溶于水,如果与工业废水混合后再电解,三价铁和三价铬都可以全部沉淀,试分析可能的原因_________ 。

(1)实验室用质量分数为98%,密度为1.84g/mL的浓硫酸配制250mL 3.68mol•L-1的硫酸溶液,需要用量筒量取浓硫酸
(2)H2O2的电子式为
(3)设计简单实验方案分离滤渣2中的2种化学成分,最佳试剂为NaOH溶液和
(4)通过钠离子交换树脂,所除杂质离子对应元素在周期表中的族序数是
(5)通入SO2过程发生反应的化学方程式为
(6)也可用Fe做电极,利用电解法将Na2Cr2O7转化为Cr(OH)3沉淀,同时有Fe(OH)3沉淀生成,整个过程所涉及到总反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某煤化工厂废水含有大量有机物、氨氮、氰化物、悬浮颗粒等有害物质,处理流程如图所示。
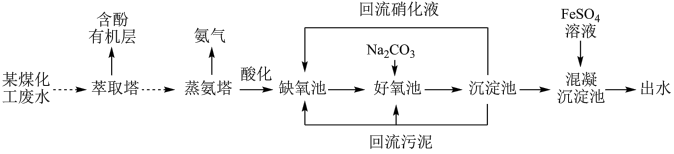
(1)萃取塔中经过______ (填写操作名称)可将含酚有机层分离出来。
(2)蒸氨塔中需要连续加入碱液并保持较高温度。请从化学平衡角度解释回答下列问题。
①写出蒸氨塔中主要的化学平衡的离子方程式:______ 。
②加入碱液以及保持较高温度的原因:______ 。
(3)缺氧池中含有NH 及CN-,其中CN-(C为+2价)可被回流硝化液中的NO
及CN-,其中CN-(C为+2价)可被回流硝化液中的NO 氧化为无毒气体。请预测CN-反应后的产物为
氧化为无毒气体。请预测CN-反应后的产物为______ 和______ 。请分析由蒸氨塔到缺氧池工序酸化的目的:______ 。
(4)好氧池中富含O2与NH 反应后的产物为NO
反应后的产物为NO ,写出该反应的离子方程式:
,写出该反应的离子方程式:______ 。
(5)出水检测
甲醛法可以测定水样中NH 的含量,其反应原理为:4NH
的含量,其反应原理为:4NH +6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。
+6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。
实验步骤:
i.移取VmL出水样品,以酚酞为指示剂,用cmol/LNaOH标准液滴定至终点,中和样品中的酸。消耗NaOH溶液的体积为V1mL;
ii.另取同样体积的样品,加入足量的中性甲醛溶液,摇匀,静置5min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V2mL。
①步骤ii中滴定至终点的现象为______ 。
②该水样中残留NH 浓度为
浓度为______ mol/L。

(1)萃取塔中经过
(2)蒸氨塔中需要连续加入碱液并保持较高温度。请从化学平衡角度解释回答下列问题。
①写出蒸氨塔中主要的化学平衡的离子方程式:
②加入碱液以及保持较高温度的原因:
(3)缺氧池中含有NH
 及CN-,其中CN-(C为+2价)可被回流硝化液中的NO
及CN-,其中CN-(C为+2价)可被回流硝化液中的NO 氧化为无毒气体。请预测CN-反应后的产物为
氧化为无毒气体。请预测CN-反应后的产物为(4)好氧池中富含O2与NH
 反应后的产物为NO
反应后的产物为NO ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)出水检测
甲醛法可以测定水样中NH
 的含量,其反应原理为:4NH
的含量,其反应原理为:4NH +6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。
+6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。实验步骤:
i.移取VmL出水样品,以酚酞为指示剂,用cmol/LNaOH标准液滴定至终点,中和样品中的酸。消耗NaOH溶液的体积为V1mL;
ii.另取同样体积的样品,加入足量的中性甲醛溶液,摇匀,静置5min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V2mL。
①步骤ii中滴定至终点的现象为
②该水样中残留NH
 浓度为
浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为_____ 。
(2)进水pH对氨氮去除率和出水pH的影响如下图所示
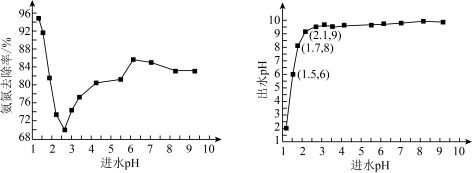
①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_____
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_____
③进水pH应控制在_____ 左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_____ (填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
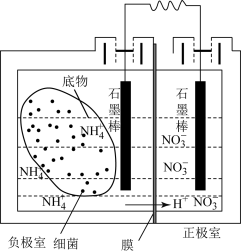
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为_____ 。该装置除了能对氨氮废水进行处理外,另一个突出的优点是_____ 。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为
(2)进水pH对氨氮去除率和出水pH的影响如下图所示

①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是
③进水pH应控制在
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为

您最近一年使用:0次



