探究硫及其化合物的转化,有现实意义。
相关反应:I 2SO2(g)+O2(g)⇌2SO3(g) ΔH1
II 2NO(g)+O2(g)⇌2NO2(g) ΔH 2
III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3
(1)一定温度下,压强恒定的密闭容器中发生反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是______
A.ΔH1<0,反应I在较低温能自发进行
B.反应混合气组分中SO2和SO3分压比不变,可作为达到化学平衡状态的判据
C.若向反应体系中充入一定量NO2气体,有利于提高SO3的平衡产率
D.增大O2分压可提高SO2的平衡转化率
(2)精制炉气各组分的体积分数SO27%、O211%、N282%,选择五氧化二钒(V2O5)作催化剂合成SO3,SO2的平衡转化率与反应温度和压强的关系如图。

①实际生产选择图中A点的反应条件,不选择B、C点理由分别是______ 。
②计算,D点SO3的分压是______ Mpa(结果保留两位有效数字)
(3)已知:标准生成焓:在298K,100kPa条件下,由最稳定的单质生成单位物质的量的纯物质的热效应。反应ΔH=生成物的标准生成焓总和-反应物的标准生成焓总和。
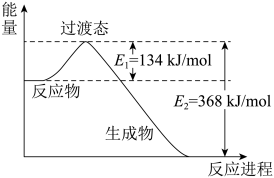
反应III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3=_______ kJ/mol
(4)煤炭燃烧采用钙基固硫技术可减少SO2排放,但煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应I CaSO4(s)+CO(g) ⇌CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ∙mol-1
反应II CaSO4(s)+4CO(g) ⇌CaS(s) + 4CO2(g) ΔH2=-175.6kJ∙mol-1
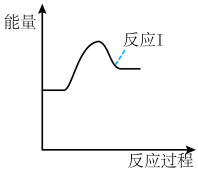
某温度下,若反应I的速率远大于反应II,反应I、II的反应物的初始能量相等,请在图中画出反应II的过程能量变化示意图:_______ 。
相关反应:I 2SO2(g)+O2(g)⇌2SO3(g) ΔH1
II 2NO(g)+O2(g)⇌2NO2(g) ΔH 2
III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3
(1)一定温度下,压强恒定的密闭容器中发生反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是
A.ΔH1<0,反应I在较低温能自发进行
B.反应混合气组分中SO2和SO3分压比不变,可作为达到化学平衡状态的判据
C.若向反应体系中充入一定量NO2气体,有利于提高SO3的平衡产率
D.增大O2分压可提高SO2的平衡转化率
(2)精制炉气各组分的体积分数SO27%、O211%、N282%,选择五氧化二钒(V2O5)作催化剂合成SO3,SO2的平衡转化率与反应温度和压强的关系如图。

①实际生产选择图中A点的反应条件,不选择B、C点理由分别是
②计算,D点SO3的分压是
(3)已知:标准生成焓:在298K,100kPa条件下,由最稳定的单质生成单位物质的量的纯物质的热效应。反应ΔH=生成物的标准生成焓总和-反应物的标准生成焓总和。
| 物质 | 标准生成焓ΔfHθmkI/mol | 物质 | 标准生成焓ΔfHθmkI/mol |
| O2(g) | 0 | SO2(g) | -296.9 |
| N2(g) | 0 | SO3(g) | -395.2 |
| S(斜方硫,s) | 0 | NO(g) | 89.9 |
| NO2(g) | 33.9 |
反应III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3=
(4)煤炭燃烧采用钙基固硫技术可减少SO2排放,但煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应I CaSO4(s)+CO(g) ⇌CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ∙mol-1
反应II CaSO4(s)+4CO(g) ⇌CaS(s) + 4CO2(g) ΔH2=-175.6kJ∙mol-1
某温度下,若反应I的速率远大于反应II,反应I、II的反应物的初始能量相等,请在图中画出反应II的过程能量变化示意图:

更新时间:2020-11-28 11:30:38
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】依据事实,书写下列热化学方程式:
(1)在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2,吸热131.5kJ:_______ 。
(2)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式_______ 。
(3)已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6kJ·mol-1;
2NO(g)+O2(g)⇌2NO2(g) ΔH=-113.0kJ·mol-1
请写出NO2与SO2反应生成SO3和NO的热化学方程式_______ 。
(4)如图所示是NO2和CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:_______ 。
(1)在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2,吸热131.5kJ:
(2)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式
(3)已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6kJ·mol-1;
2NO(g)+O2(g)⇌2NO2(g) ΔH=-113.0kJ·mol-1
请写出NO2与SO2反应生成SO3和NO的热化学方程式
(4)如图所示是NO2和CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ/mol。

请回答下列问题:
①图中A点表示:_________________________
C点表示:_____________________________
E的大小对该反应的反应热____________ (填“有”或“无”)影响。
②图中△H=______________ kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:__________________________
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH =__________ kJ/mol。氢气的燃烧热为ΔH =__________ kJ/mol。
 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ/mol。
请回答下列问题:
①图中A点表示:
C点表示:
E的大小对该反应的反应热
②图中△H=
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH =
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
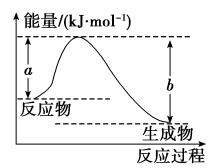
【推荐3】(1)如图表示某反应的能量变化关系,则此反应ΔH=___________ (用含有a、b的关系式表示)。
(2) NaBH4(s)与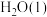 反应生成
反应生成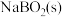 和
和 。在25℃,101kPa下,已知每消耗
。在25℃,101kPa下,已知每消耗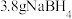
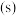 放热
放热 ,该反应的热化学方程式是
,该反应的热化学方程式是___________ 。
(3)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是 和Zn,电解质溶液为KOH溶液,总反应式为
和Zn,电解质溶液为KOH溶液,总反应式为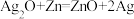 。回答下列问题:
。回答下列问题:
①Zn极发生___________ 反应,该电池的正极反应式为___________ 。
②当电池外电路中有1mol 通过时,负极消耗的物质的质量是
通过时,负极消耗的物质的质量是___________ g。
③在使用过程中,电解质溶液中KOH的物质的量___________ (填“增大”“减小”或“不变”)。

(2) NaBH4(s)与
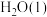 反应生成
反应生成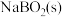 和
和 。在25℃,101kPa下,已知每消耗
。在25℃,101kPa下,已知每消耗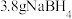
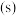 放热
放热 ,该反应的热化学方程式是
,该反应的热化学方程式是(3)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是
 和Zn,电解质溶液为KOH溶液,总反应式为
和Zn,电解质溶液为KOH溶液,总反应式为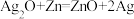 。回答下列问题:
。回答下列问题:①Zn极发生
②当电池外电路中有1mol
 通过时,负极消耗的物质的质量是
通过时,负极消耗的物质的质量是③在使用过程中,电解质溶液中KOH的物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1
②2CO(g)+O2(g) = 2CO2(g) ΔH2= -566.0 kJ·mol-1
③H2O(g) = H2O(l) ΔH3= -44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①该反应的平衡常数表达式K=_______ ,一定条件下CH4的平衡转化率与温度、压强的关系如图。则T1_______ T2 (填“<”或“>”或“=”)。
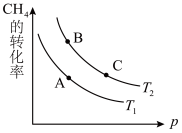
②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,不能 说明该反应已经达到平衡状态的是_______ 。
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3V正(CH4)=V逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,则该电池负极的电极反应式为_______ 。当有4mol电子通过导线时,消耗标准状况下的O2体积为_______ L。

(1)已知:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1
②2CO(g)+O2(g) = 2CO2(g) ΔH2= -566.0 kJ·mol-1
③H2O(g) = H2O(l) ΔH3= -44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①该反应的平衡常数表达式K=

②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3V正(CH4)=V逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,则该电池负极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是一种重要的可再生资源。
(1)已知:2CH4(g)+O2(g) =2CO(g)+4H2(g) △H=akJ•mol-1
CO(g) +2H2(g)=CH3OH(g) △H=bkJ•mol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式:____________________________ 。
(2)反应:CO(g)+2H2(g) CH3OH(g)的平衡常数K的表达式为
CH3OH(g)的平衡常数K的表达式为________________ ;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________ 。
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图乙所示。
①能判断该反应达到化学平衡状态的是_______ (填选项字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较A、B两点压强大小P(A)________ P(B)(填“>、<、=”)。
③比较KA、KB、KC的大小:________________ 。
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,写出燃料电池负极的电极反应式:________________________ 。
(1)已知:2CH4(g)+O2(g) =2CO(g)+4H2(g) △H=akJ•mol-1
CO(g) +2H2(g)=CH3OH(g) △H=bkJ•mol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式:
(2)反应:CO(g)+2H2(g)
 CH3OH(g)的平衡常数K的表达式为
CH3OH(g)的平衡常数K的表达式为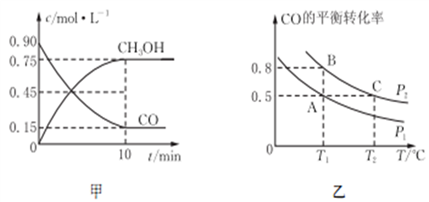
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图乙所示。
①能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较A、B两点压强大小P(A)
③比较KA、KB、KC的大小:
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,写出燃料电池负极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氢能作为公认的清洁能源正在脱颖而出,我国在氢能的开发和利用上处于世界领先水平。回答下列问题:
Ⅰ.已知:
i.C(s)+H2O(g) CO(g)+H2(g) △H1= +131.4 kJ/mol
CO(g)+H2(g) △H1= +131.4 kJ/mol
ii.CO(g)+ H2O(g) CO2(g)+H2(g) △H2= -41.2 kJ/ mol
CO2(g)+H2(g) △H2= -41.2 kJ/ mol
(1)碳与CO2反应生成28 g CO的反应热△H=___________ 。
(2)一定温度下,向10 L恒容密闭容器中充入1 mol CO和1 mol H2O(g)仅发生反应ii,5 min末恰好达到平衡。用CO表示的正反应速率与时间的变化关系如图所示。

①平衡体系中H2的体积分数为__________ ;CO的平衡转化率为____________ 。
②下列事实能说明反应i-定达到平衡状态的是_________ (填选项字母)。
A.容器内气体压强不再改变
B.CO与H2的物质的量之比不再改变
C.消耗0.1 mol H2O同时生成0.1 mol CO2
③若6 min时升高温度,则此时正反应速率__________ (填“增大”、“减小”或“不变")。
Ⅱ.氢氧碱性燃料电池巳在航天、汽车等领域成功应用,其装置示意图如图所示。

(3)正极的电极反应式为_____________ 。
(4)若导线中通过1 mol e-的电量,理论上正极和负极上消耗标准状况下气体的体积之和为______ L。
(5)若放电后电池中KOH溶液的密度为ρ g·cm-3、质量分数为w。取55.0 mL该溶液与50.0 mL等浓度的盐酸混合,所得混合溶液的密度为p2 g·cm-3、比热容为c J·(kg·℃)-1,混合后溶液温度升高了t ℃,假设溶液体积可以相加。则强酸与强碱反应的中和热△H=______ kJ/mol(用代数式表示)。
Ⅰ.已知:
i.C(s)+H2O(g)
 CO(g)+H2(g) △H1= +131.4 kJ/mol
CO(g)+H2(g) △H1= +131.4 kJ/molii.CO(g)+ H2O(g)
 CO2(g)+H2(g) △H2= -41.2 kJ/ mol
CO2(g)+H2(g) △H2= -41.2 kJ/ mol(1)碳与CO2反应生成28 g CO的反应热△H=
(2)一定温度下,向10 L恒容密闭容器中充入1 mol CO和1 mol H2O(g)仅发生反应ii,5 min末恰好达到平衡。用CO表示的正反应速率与时间的变化关系如图所示。

①平衡体系中H2的体积分数为
②下列事实能说明反应i-定达到平衡状态的是
A.容器内气体压强不再改变
B.CO与H2的物质的量之比不再改变
C.消耗0.1 mol H2O同时生成0.1 mol CO2
③若6 min时升高温度,则此时正反应速率
Ⅱ.氢氧碱性燃料电池巳在航天、汽车等领域成功应用,其装置示意图如图所示。

(3)正极的电极反应式为
(4)若导线中通过1 mol e-的电量,理论上正极和负极上消耗标准状况下气体的体积之和为
(5)若放电后电池中KOH溶液的密度为ρ g·cm-3、质量分数为w。取55.0 mL该溶液与50.0 mL等浓度的盐酸混合,所得混合溶液的密度为p2 g·cm-3、比热容为c J·(kg·℃)-1,混合后溶液温度升高了t ℃,假设溶液体积可以相加。则强酸与强碱反应的中和热△H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】丙烯是重要的石油化工中间体,工业上常用丙烷催化脱氢和甲醇催化分解等方法制备。回答下列问题:
I.丙烷催化脱氢法制丙烯:C3H8(g) C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
(1)该反应在___________ (填“高温”、“低温”或“任意温度”)时可自发进行。
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp=________ kPa。(结果保留3位有效数字,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压-总压×物质的量分数)
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g) C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为___________ 。
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
(5)该反应的实验数据遵循 Arhenius 经验公式: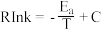 (Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
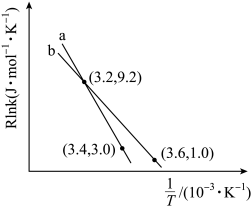
(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得___________ 。(填“越多”或“越少”)。根据如图曲线a计算该反应的活化能E,为___________ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________ 。
I.丙烷催化脱氢法制丙烯:C3H8(g)
 C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。(1)该反应在
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp=
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g)
 C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
| A.CO2的物质的量分数保持不变 |
| B.n(H2O):n(CO)保持不变 |
| C.气体密度保持不变 |
| D.速率关系:v(C3H8)=c(C3H6) |
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
(5)该反应的实验数据遵循 Arhenius 经验公式:
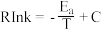 (Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:_________________________________ 。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s) Mn0(s)+CO2(g) △H1 K1
Mn0(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g) 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n) +O2(g) 2MnO2(s) +2CO2(g) △H3 K3
2MnO2(s) +2CO2(g) △H3 K3
△H3=________ 用△H1,△H2表示);K3=________ 用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H3________ 0(填“>"“<"或“=")。
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s) MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
①温度、压强对MnCO3分解率的影响如图所示:
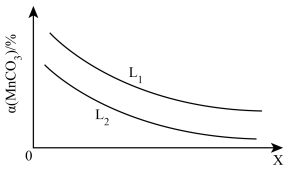
比较:L1__________ L2(填“>"“<”或“=")。
②保持温度不变,将容器体积扩大至原来的2倍,则ρ(CO2)的变化范围是____________ 。
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是____ (填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为
2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________ 。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)
 Mn0(s)+CO2(g) △H1 K1
Mn0(s)+CO2(g) △H1 K1②2MnO(s)+O2(g)
 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2③2MnCO3(n) +O2(g)
 2MnO2(s) +2CO2(g) △H3 K3
2MnO2(s) +2CO2(g) △H3 K3△H3=
(3)反应②在低温条件下能自发进行,则△H3
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s)
 MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。①温度、压强对MnCO3分解率的影响如图所示:

比较:L1
②保持温度不变,将容器体积扩大至原来的2倍,则ρ(CO2)的变化范围是
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g)
 2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为
2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。
Ⅰ.利用 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:
反应①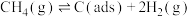

反应②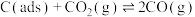

有关物质的相对能量与反应历程的变化如图所示[ 为吸附性活性炭]:
为吸附性活性炭]:
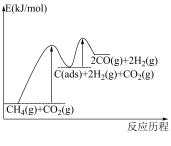
(1)总反应 能自发进行的条件为
能自发进行的条件为_______ 。
(2)总反应速率由反应_______ (填“①”或“②”)决定,增加 的浓度,
的浓度,_______ (填“能”或“不能”)显著提升总反应的速率。
Ⅱ.工业上可利用 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:
反应③

反应④
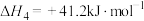
在5MPa的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。

(3)在425℃~675℃范围内(其他条件不变), 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:_______ ,_______ 。
(4)下列说法正确的是_______(填字母)。
(5)反应④在545K时的平衡常数
_______ 。
(6)结合上图,在下图中画出 的平衡产率随温度的变化曲线
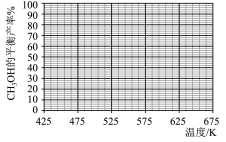
的平衡产率随温度的变化曲线_______ (标出B点坐标)。
 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。Ⅰ.利用
 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:反应①
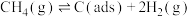

反应②
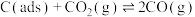

有关物质的相对能量与反应历程的变化如图所示[
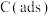 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应
 能自发进行的条件为
能自发进行的条件为(2)总反应速率由反应
 的浓度,
的浓度,Ⅱ.工业上可利用
 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:反应③


反应④

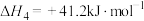
在5MPa的恒压反应器中,按照
 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。
(3)在425℃~675℃范围内(其他条件不变),
 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:(4)下列说法正确的是_______(填字母)。
| A.曲线Ⅱ代表CO的选择性随温度的变化 |
B.温度越低,越有利于工业生产 |
C.上述反应条件下, 的平衡转化率等于 的平衡转化率等于 的平衡转化率 的平衡转化率 |
D.原料气中掺入适量CO能提高 的产率 的产率 |
(5)反应④在545K时的平衡常数

(6)结合上图,在下图中画出
 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线
您最近一年使用:0次



