在0.1mol/L的醋酸溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+,对于该平衡,下列说法正确的是( )
| A.加入冰醋酸可以促进原平衡向正反应方向移动,使得溶液中氢离子浓度增大 |
| B.加入浓盐酸可以使原平衡向逆反应方向移动,溶液中氢离子浓度减小 |
| C.加入少量的醋酸钠固体,平衡向正反应方向移动 |
| D.加入水稀释可以促使原平衡向正反应方向移动,使得溶液中氢离子浓度增大 |
更新时间:2020-11-22 17:53:13
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】25℃时,下列关于亚硫酸及其钾盐的说法不正确的是
| A.pH=3的KHSO3溶液稀释后,溶液中各离子浓度均减小 |
| B.K2SO3溶液和KHSO3溶液中含有的离子种类完全相同 |
| C.若0.1mol/LKHSO3溶液的pH=2,则0.1mol/LH2SO3溶液中c(H+)一定小于0.11mol/L |
D.H2SO3溶液中c(H+)∙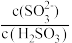 减小,可能的措施是加入KHSO4固体 减小,可能的措施是加入KHSO4固体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】若保持温度不变,向氨水中通入一定量HCl气体,下列会减小的是
| A.c(NH4+) | B.c(OH-)/c(H+) | C.Kw | D.Kb(NH3 • H2O) |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】25℃时,0.2mol·L-1的HX溶液中c(HX)∶c(X-)=99∶1,下列说法正确的是
| A.升温至30℃时,溶液c(HX)∶c(X-)>99∶1 |
| B.25℃时K(HX)≈2×l0-5 |
| C.向溶液中加入适量NaX溶液,酸的电离平衡向左移动,新平衡时c(X-)减小 |
| D.加水稀释后,溶液中c(X-)、c(H+)、c(OH-)均减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】相同温度下,100mL 0.01 mol·L-1的醋酸溶液与10mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
| A.中和时所需NaOH的量 | B.c(H+) |
| C.c(OH-) | D.c(CH3COOH) |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列关于醋酸溶液的说法正确的是
| A.升高温度,溶液中的CH3COOH分子浓度不变 |
| B.室温下,稀释0.1 mol·L-1 CH3COOH溶液,溶液的导电能力增强 |
| C.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| D.向醋酸溶液中加入少量氢氧化钠固体,能促进醋酸的电离 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】25℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
 H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体醋酸钠,水的电离程度增大,Kw增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】从植物花汁中提取的一种有机物HIn,可做酸碱指示剂,在水溶液中存在电离平衡:HIn(红色)  H++In-(黄色) ΔH>0,在含有HIn的水溶液中,某同学加入以下物质能使溶液显黄色的是
H++In-(黄色) ΔH>0,在含有HIn的水溶液中,某同学加入以下物质能使溶液显黄色的是
①NaOH ②HCl ③NaCl ④Na2O ⑤Na2CO3 ⑥NaHSO4 ⑦SO2 ⑧NH3
 H++In-(黄色) ΔH>0,在含有HIn的水溶液中,某同学加入以下物质能使溶液显黄色的是
H++In-(黄色) ΔH>0,在含有HIn的水溶液中,某同学加入以下物质能使溶液显黄色的是①NaOH ②HCl ③NaCl ④Na2O ⑤Na2CO3 ⑥NaHSO4 ⑦SO2 ⑧NH3
| A.①⑤⑥⑧ | B.①④⑤⑧ |
| C.②⑥⑦ | D.②③⑥⑦ |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】下列操作中,能使电离平衡H2O⇌H++OH-,向右移动且溶液呈酸性的是
| A.向水中加入NaHSO4溶液 |
| B.向水中加入Fe2(SO4)3固体 |
| C.向水中加入K2CO3溶液 |
| D.将水加热到100℃,使pH=6 |
您最近一年使用:0次

 CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中 值增大,可以采取的措施是
值增大,可以采取的措施是
 NH3·H2O
NH3·H2O

