(1)试运用盖斯定律回答下列问题:
(1)已知:H2O(g)===H2O(l) ΔH1= -Q1kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH2= -Q2kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3= -Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
(2)碳(s)在氧气供应不充分时,生成CO的同时还生成部分CO2,因此无法通过实验直接测得反应C(s)+ O2(g)=CO(g)的ΔH。但可设计实验,利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
O2(g)=CO(g)的ΔH。但可设计实验,利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
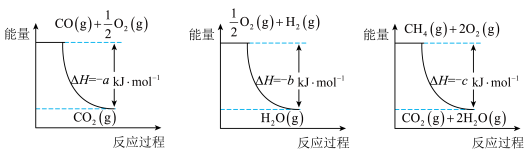
计算丙烷的燃烧热有两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ·mol-1。
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g) ΔH=+b kJ·mol-1;
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1;
2H2(g)+O2(g)===2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)。
请回答下列问题:
(3)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
(4)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量
(5)b与a、c、d的数学关系式是
相似题推荐

请回答下列问题:
(1)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量
②为提高H2的转化率,实际生产中宜采取的措施有
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K
②若其他条件不变,则下列图象正确的是

【推荐2】化学反应中均伴随有能量变化。
回答下列问题:
(1)下列反应中,反应物的总能量小于生成物的总能量的是
A. 与
与 反应
反应
B.乙醇的燃烧反应
C. 受热分解
受热分解
(2)已知
 时,下列物质的相对能量如表所示:
时,下列物质的相对能量如表所示:物质 |
|
|
|
|
相对能量( | 0 | 0 |
|
|
①表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为
② 转化为
转化为
 的热量。
的热量。
③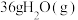 分解生成
分解生成 和
和
 的热量。
的热量。
(3)已知:Ⅰ.

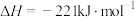
Ⅱ.
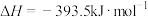
根据盖斯定律计算

 。
。
(1)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) ∆H=+44.0 kJ·mol-1写出表示甲醇燃烧热的热化学方程式
(2)已知:CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g) ∆H1=-192.9kJ·mol-1
CO2(g)+2H2(g) ∆H1=-192.9kJ·mol-1H2(g)+
 O2 (g)
O2 (g)  H2O(g) ∆H2=-120.9kJ·mol-1
H2O(g) ∆H2=-120.9kJ·mol-1则甲醇与水蒸气催化重整反应的焓变∆H3
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2)的反应方程式为:C6H5—CH2CH3(g)
 C6H5—CH=CH2(g)+H2(g) ∆H1
C6H5—CH=CH2(g)+H2(g) ∆H1已知:3C2H2(g)
 C6H6(g) ∆H2;C6H6(g)+C2H4(g)
C6H6(g) ∆H2;C6H6(g)+C2H4(g) C6H5—CH2CH3(g) ∆H3
C6H5—CH2CH3(g) ∆H3则反应3C2H2(g)+C2H4(g)
 C6H5—CH=CH2(g) +H2(g)的∆H =
C6H5—CH=CH2(g) +H2(g)的∆H =(4)氨的合成是最重要的化工生产之一。工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:
 ;
;②用天然气跟水蒸气反应:
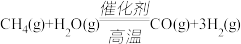 已知有关反应的能量变化如图所示,则方法②中反应的∆H =
已知有关反应的能量变化如图所示,则方法②中反应的∆H =
(1)系统(I)中的催化剂是
(2)通过计算,书写系统(Ⅱ)制氢气的热化学方程式:
(3)为了测定HI和NaOH稀溶液反应的中和热,计算时至少需要的数据是______。
①HI溶液的浓度和体积 ②NaOH 溶液的浓度和体积
③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后温度变化
⑦操作所需的时间
| A.②③⑥ | B.①③④⑤ | C.③④⑤⑥ | D.全部 |
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g) △H1= +207 kJ/mol
MgH2(s)=Mg(s)+H2(g) △H2=+75 kJ/mol
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g) △H3=+184 kJ/mol
①△H3<△H1+△H2的原因是
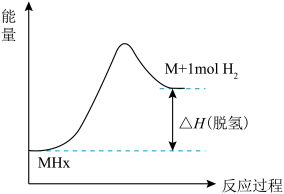
②储氢材料脱氢的能量变化如图所示。三种材料中脱氢焓△H (脱氢)最小的是
 )常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
)常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:I.
 (g)+HCl(g)→
(g)+HCl(g)→ (g) △H1=-54 kJ·mol-1
(g) △H1=-54 kJ·mol-1II.
 (g)+H2(g)→
(g)+H2(g)→ (g) △H2=-121 kJ·mol-1
(g) △H2=-121 kJ·mol-1III.
 (g)+Cl2(g)→
(g)+Cl2(g)→ (g)+HCl(g) △H3
(g)+HCl(g) △H3IV.H2(g)+Cl2(g)=2HCl(g) △H4=-185 kJ·mol-1
回答下列问题:
(1)①根据上述反应计算得△H3=
②反应II每生成5.3 g苯乙烷,放出的热量为
(2)相关化学键的键能数据如下表所示。
| 化学键 | Cl Cl Cl | H Cl Cl | H H H |
| 键能/kJ·mol-1 | 243 | x | 436 |
①x=
②完全燃烧5.2 g苯乙烯,消耗氧气
③苯乙烯在一定条件下能形成聚合物,其聚合反应的化学方程式为
Cu(s)+Cu2+(aq)⇌2Cu+(aq)△H1=akJ•mol-1
Cl-(aq)+Cu+(aq)⇌CuCl(s)△H2=bkJ•mol-1
(1)反应Cu(s)+Cu2+(aq)+2Cl-(aq)⇌2CuCl(s) △H=
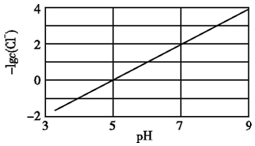
(2)实验测得电解液pH对溶液中残留
 的影响如上图所示。当pH=7时,溶液中
的影响如上图所示。当pH=7时,溶液中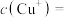
(3)兴趣小组在CuCl2溶液中加入过量KI固体,观察到有白色沉淀生成。推测该白色沉淀中一定含有的物质是
| 物质 | CuCl | CuI | CuI2 |
 |  |  | - |
| 颜色 | 白色 | 白色 | 金黄色 |
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
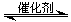 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中V(正)、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)

 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0—6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”);
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。下图E,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g)
 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。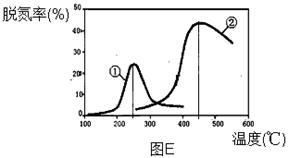
①该反应的△S 0,△H 0(填“>”、“=”或“<”)。
②以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
③已知:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2NaOH = 2NaNO2 + H2O标况下V升NO和NO2的混合气体通100mLNaOH溶液恰好完全反应,则NO和NO2的体积比是
 ,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为
(2)探究温度对化学反应速率影响的实验编号是
(3)已知50 ℃时c(MnO4—)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4—)~t的变化曲线示意图
(4)在25 ℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.0kJ,则表示甲烷燃烧热的热化学方程式是
(5)已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示。该反应是一个
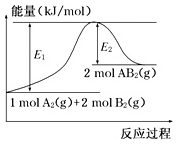
A.该反应是放热反应
B.该反应的ΔH=-(E1-E2) kJ· mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
(1)在25℃、101 kPa下,1 g甲醇(液态)完全燃烧后,恢复到原状态放热Q kJ,则表示甲醇燃烧热的热化学方程式为
(2)工业上利用甲醇制备氢气常用的方法之一是甲醇蒸气重整法。此方法当中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),说明该反应能自发进行的原因
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。

①通入气体a的电极是电池的
②当电池中有2 mole-发生转移时,左右两侧溶液的质量之差为







