现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到潮湿的空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4 g C与足量热水反应时,在标准状况下放出气体2.24 L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B元素的元素符号:______ ,指出D在周期表中的位置_____ 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为_______ (用化学式表示)。
(3)写出淡黄色固体E的电子式________ ,其中含有的化学键为_______ 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式__________ 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为________ 。
(1)写出B元素的元素符号:
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为
(3)写出淡黄色固体E的电子式
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式
更新时间:2020-11-29 19:32:35
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图:
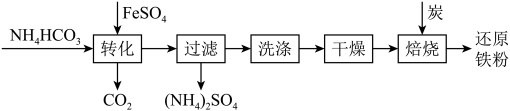
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如图装置模拟上述流程中的“转化”环节。
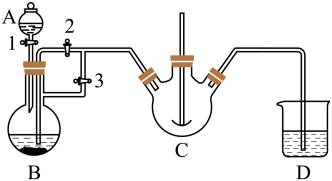
(1)装置A的名称是______ ,NH4HCO3盛放在装置______ 中。(填装置字母编号)
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合生成FeCO3沉淀,操作方法是_____ ,发生主要反应的离子方程式为______ 。
(3)检验久置的FeSO4是否变质的方法是_____ 。
(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeO(OH),该反应的化学方程式为______ ,取干燥后的FeCO3样品11.33g,与炭混合后焙烧(已知炭均可将FeCO3和FeO(OH)还原),最终得到还原铁粉5.6g,计算样品中FeCO3的质量为:______ 。

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如图装置模拟上述流程中的“转化”环节。

(1)装置A的名称是
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合生成FeCO3沉淀,操作方法是
(3)检验久置的FeSO4是否变质的方法是
(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeO(OH),该反应的化学方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氧化镁在医药、耐火材料、电子等行业具有广泛的用途,在国民经济中占有重要的地位。某批次白云石的成分及质量分数分别为 (50.00%)、
(50.00%)、 (44.10%)、
(44.10%)、 (4.85%)、
(4.85%)、 (0.58%)、
(0.58%)、 (0.47%),用白云石碳化法制备氧化镁的工艺流程如下:
(0.47%),用白云石碳化法制备氧化镁的工艺流程如下:
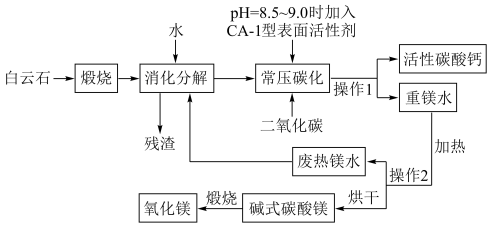
回答下列问题:
(1)提高煅烧效率比较有效的方法是________ 。
(2)将该批次白云石加热到950℃,煅烧1小时,固体成分为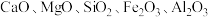 的混合物,此时MgO所占的质量分数为
的混合物,此时MgO所占的质量分数为______ (保留2位有效数字);“消化分解”中向混合物中加入一定量的水可制成一定浓度的白云灰乳,该工序产生的残渣的主要成分为_______ 。
(3)“常压碳化”工序:将白云灰乳在碳化塔中用一定浓度的二氧化碳气体碳化,当碳化液pH突降至8.5~9.0时,加入CA-1型表面活性剂(该活性剂可专一地包覆在碳酸钙表面)继续碳化,至pH为6.5时停止碳化。
①碳化时反应的化学方程式为________ 。
②碳化的目的是_______ 。
③加入CA-1型表面活性剂的作用为________ 。
(4)可通过热重分析法对碱式碳酸镁[ ]的组成进行测定。已知碱式碳酸镁受热首先失去结晶水,受热分解的产物为三种氧化物,热重分析图如下:
]的组成进行测定。已知碱式碳酸镁受热首先失去结晶水,受热分解的产物为三种氧化物,热重分析图如下:

 ,则碱式碳酸镁的化学式为
,则碱式碳酸镁的化学式为______ 。
(5)“废热镁水”回到“消化分解”工序,体现了_______ 的生产思想,还可以利用________ (填化学式)的再生实现这一生产思想。
 (50.00%)、
(50.00%)、 (44.10%)、
(44.10%)、 (4.85%)、
(4.85%)、 (0.58%)、
(0.58%)、 (0.47%),用白云石碳化法制备氧化镁的工艺流程如下:
(0.47%),用白云石碳化法制备氧化镁的工艺流程如下:
回答下列问题:
(1)提高煅烧效率比较有效的方法是
(2)将该批次白云石加热到950℃,煅烧1小时,固体成分为
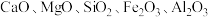 的混合物,此时MgO所占的质量分数为
的混合物,此时MgO所占的质量分数为(3)“常压碳化”工序:将白云灰乳在碳化塔中用一定浓度的二氧化碳气体碳化,当碳化液pH突降至8.5~9.0时,加入CA-1型表面活性剂(该活性剂可专一地包覆在碳酸钙表面)继续碳化,至pH为6.5时停止碳化。
①碳化时反应的化学方程式为
②碳化的目的是
③加入CA-1型表面活性剂的作用为
(4)可通过热重分析法对碱式碳酸镁[
 ]的组成进行测定。已知碱式碳酸镁受热首先失去结晶水,受热分解的产物为三种氧化物,热重分析图如下:
]的组成进行测定。已知碱式碳酸镁受热首先失去结晶水,受热分解的产物为三种氧化物,热重分析图如下:
 ,则碱式碳酸镁的化学式为
,则碱式碳酸镁的化学式为(5)“废热镁水”回到“消化分解”工序,体现了
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板。
(1)写出 FeCl3溶液与金属铜反应的离子方程式___________ 。
(2)某小组采取下列步骤从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液:
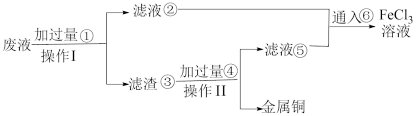
ⅰ.操作Ⅰ和操作Ⅱ使用到的主要玻璃仪器有___________ 。
ⅱ.若某腐蚀液中含1.5mol/L CuCl2、3.0mol/L FeCl2、1.0mol/L FeCl3,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为___________ 。
ⅲ.向滤液②中加入NaOH溶液的现象是___________ 。
(3)实验室里保存FeCl2溶液时,常加入铁钉或铁粉防止Fe2+被氧化,请用离子方程式说明其原因___________ 。
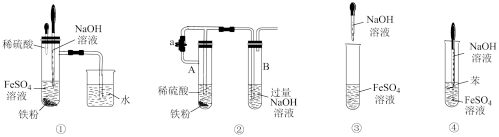
(4)下列各图示中能较长时间观察到Fe(OH)2的是___________(填字母)。
(5)在查阅资料后,有同学认为Fe(OH)2被空气中的氧气氧化后生成Fe3(OH)8,Fe3(OH)8中n(Fe2+):n(Fe3+)=___________ 。
(1)写出 FeCl3溶液与金属铜反应的离子方程式
(2)某小组采取下列步骤从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液:

ⅰ.操作Ⅰ和操作Ⅱ使用到的主要玻璃仪器有
ⅱ.若某腐蚀液中含1.5mol/L CuCl2、3.0mol/L FeCl2、1.0mol/L FeCl3,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为
ⅲ.向滤液②中加入NaOH溶液的现象是
(3)实验室里保存FeCl2溶液时,常加入铁钉或铁粉防止Fe2+被氧化,请用离子方程式说明其原因
(4)下列各图示中能较长时间观察到Fe(OH)2的是___________(填字母)。

| A.①②③ | B.①②④ | C.①②③④ | D.②③④ |
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知:①A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素。
②A的某种原子核内没有中子。
③A和D、C和F分别为同一主族元素。
④B原子的最外层电子数比次外层电子数多3。
⑤E的氧化物具有两性。
⑥F的单质常出现在火山口。
(1)D在元素周期表中的位置是______ 。
(2)C、D、E分别形成的简单离子按半径由大到小的顺序排列为______ (填离子符号);
F和G的最高价氧化物的水化物中,酸性较强的是(填化学式)______ 。
(3)D与E的最高价氧化物的水化物相互反应的离子方程式为______ 。
(4)C与D可形成一种淡黄色的固体,其中含有的化学键为______ 。
写出这种物质与水发生反应的化学方程式。______ 。
(5)B和G可按1:3的比例形成一种化合物,熔点为—40℃,其晶体类型是______ 。该化合物中B和G都达到8电子稳定结构,它的电子式是______ 。该化合物遇热水生成一种具有漂白性的化合物和一种刺激性气味的气体,发生反应的化学方程式为______ 。
(6)A和B可形成18电子化合物,它的结构式是______ 。该化合物可与O2组成燃料电池,写出以 溶液为电解质溶液时正极发生的电极反应方程式
溶液为电解质溶液时正极发生的电极反应方程式______ 。
②A的某种原子核内没有中子。
③A和D、C和F分别为同一主族元素。
④B原子的最外层电子数比次外层电子数多3。
⑤E的氧化物具有两性。
⑥F的单质常出现在火山口。
(1)D在元素周期表中的位置是
(2)C、D、E分别形成的简单离子按半径由大到小的顺序排列为
F和G的最高价氧化物的水化物中,酸性较强的是(填化学式)
(3)D与E的最高价氧化物的水化物相互反应的离子方程式为
(4)C与D可形成一种淡黄色的固体,其中含有的化学键为
写出这种物质与水发生反应的化学方程式。
(5)B和G可按1:3的比例形成一种化合物,熔点为—40℃,其晶体类型是
(6)A和B可形成18电子化合物,它的结构式是
 溶液为电解质溶液时正极发生的电极反应方程式
溶液为电解质溶液时正极发生的电极反应方程式
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出下列四种元素的元素名称:
A:___ ,B:____ ,C:____ ,D:____ 。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:___ ,D:___ 。
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:____ 。
(4)写出B2A4的电子式:____ 。
(5)写出C3B2化合物与水反应的方程式:___ 。
(1)写出下列四种元素的元素名称:
A:
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:
(4)写出B2A4的电子式:
(5)写出C3B2化合物与水反应的方程式:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】原子序数依次增大的五种元素的性质或结构信息如下表。
回答下列问题:
(1)T元素在周期表中的位置是___________ ,其三价阳离子的价电子轨道表示式为___________ 。
(2)五种元素中电负性最大与电负性最小的元素形成化合物的化学式为___________ ,基态W原子运动状态不同的电子数为___________ 。
(3)氢元素与X、Y共同形成的一种相对分子质量最小的化合物b,分子中X、Y的原子最外层都达到8电子稳定结构,其电子式为___________ ;化合物b中所含元素的原子半径大小顺序为___________ 。
(4)W的氢化物是有机化学反应的重要还原剂、火箭推进剂及氢燃料汽车中氢气的储存材料,遇水剧烈燃烧或爆炸,写出W的氢化物遇水释放出 的化学方程式:
的化学方程式:___________ 。
| 元素 | 原子结构和性质 |
| X | 基态原子s能级的电子总数是p能级电子总数的2倍 |
| Y | 其单质含有3对共用电子对 |
| Z | 大气中大量存在着两种单质,对人类生存都有重要意义 |
| W | 单质、最高价氧化物和最高价氧化物的水化物与盐酸或NaOH溶液都能反应 |
| T | 二价阳离子的电子排布式为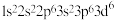 |
(1)T元素在周期表中的位置是
(2)五种元素中电负性最大与电负性最小的元素形成化合物的化学式为
(3)氢元素与X、Y共同形成的一种相对分子质量最小的化合物b,分子中X、Y的原子最外层都达到8电子稳定结构,其电子式为
(4)W的氢化物是有机化学反应的重要还原剂、火箭推进剂及氢燃料汽车中氢气的储存材料,遇水剧烈燃烧或爆炸,写出W的氢化物遇水释放出
 的化学方程式:
的化学方程式:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
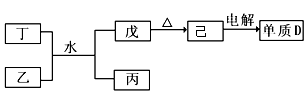
①丁与乙和水反应生成戊和丙的离子方程式为_____________ ,由物质己电解得到单质D的化学方程式为_____________________________ ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为______________ 。
(2)已知E及其化合物有以下变化:
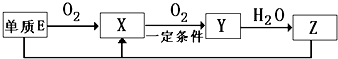
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式___________ 。
由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成C的含氧酸盐只有一种,则该含氧酸盐的化学式是______ 。
(1)已知相关物质之间存在如下变化:

①丁与乙和水反应生成戊和丙的离子方程式为
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为
(2)已知E及其化合物有以下变化:

写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式
由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成C的含氧酸盐只有一种,则该含氧酸盐的化学式是
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D均是短周期元素,A和B同周期,B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2,A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成离子化合物D2A或D2A2。请回答
(1)写出元素符号B:___ ;C:___ 。
(2)BA2的结构式___ ,BA2分子中化学键属于___ 键。
(3)D2A2的电子式___ ,D2A2中化学键属于___ 键。
(4)C在元素周期表中的位置是___ ,其原子结构示意图___ 。
(5)电子式表示化合物D2A的形成过程:___ 。
(1)写出元素符号B:
(2)BA2的结构式
(3)D2A2的电子式
(4)C在元素周期表中的位置是
(5)电子式表示化合物D2A的形成过程:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E 5种元素,已知:
①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2。DB2中D的质量分数为50%。根据以上情况回答:
(1)A是______ 、B是______ 、C是______ 、D是______ 、E是______ (写元素符号)。
(2)E的原子结构示意图__________ ,C的离子结构示意图__________ 。
(3)F和AB2反应的化学方程式________________________________________________ 。
①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2。DB2中D的质量分数为50%。根据以上情况回答:
(1)A是
(2)E的原子结构示意图
(3)F和AB2反应的化学方程式
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】下表是元素周期表的一部分,回答有关问题。
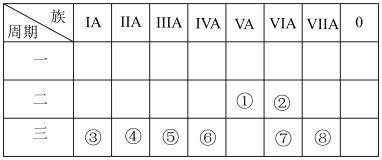
(1)在元素①~⑧中,金属性最强的元素的离子结构示意图是________ 。
(2)前三周期所有元素中,原子最外层电子数是元素所处周期数2倍的元素有_____ 种。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为________ 。
(4)在②、③、④这些元素形成的最简单离子中,离子半径由大到小的顺序为_______ (填离子符号)。
(5)⑥、⑦和⑧三种元素的最低价气态氢化物的热稳定性由弱到强的依次为______ (填化学式)。
(6)写出元素⑤的单质与元素③最高价氧化物的水化物反应的离子方程式______ 。

(1)在元素①~⑧中,金属性最强的元素的离子结构示意图是
(2)前三周期所有元素中,原子最外层电子数是元素所处周期数2倍的元素有
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为
(4)在②、③、④这些元素形成的最简单离子中,离子半径由大到小的顺序为
(5)⑥、⑦和⑧三种元素的最低价气态氢化物的热稳定性由弱到强的依次为
(6)写出元素⑤的单质与元素③最高价氧化物的水化物反应的离子方程式
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,A原子核内只有一个质子,已知B和D原子有相同的电子层数,且B的L层电子数是K层电子数的两倍,E在空气中燃烧时呈现黄色火焰,E的单质在加热下与D的单质充分反应,可以得到淡黄色固态化合物,试根据以上叙述回答:
(1)写出元素C在周期表中位置________________
(2)E的单质在加热下与D的单质充分反应,可以得到淡黄色固态化合物的电子式_________________
(3)C的氢化物与其最高价含氧酸反应的化学方程式及产物中阳离子的电子式__________ 、__________
(4)B、C、D的氢化物的稳定性的由大到小的顺序为:___________ (氢化物的化学式),理由是:________________
(1)写出元素C在周期表中位置
(2)E的单质在加热下与D的单质充分反应,可以得到淡黄色固态化合物的电子式
(3)C的氢化物与其最高价含氧酸反应的化学方程式及产物中阳离子的电子式
(4)B、C、D的氢化物的稳定性的由大到小的顺序为:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
(1)表中元素,化学性质最不活泼的是_______________ (用元素符号表示,本小题下同);可用于制半导体材料的元素是______________ 。
(2)最高价氧化物的水化物酸性最强的是__________________ (填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是_________________ (填化学式)。
(3)B和H形成化合物的电子式为________________ 。
(4)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式___________________ 。
(5)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是__________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物酸性最强的是
(3)B和H形成化合物的电子式为
(4)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式
(5)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是
您最近半年使用:0次



