短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
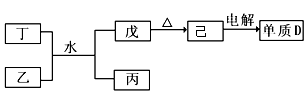
①丁与乙和水反应生成戊和丙的离子方程式为_____________ ,由物质己电解得到单质D的化学方程式为_____________________________ ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为______________ 。
(2)已知E及其化合物有以下变化:
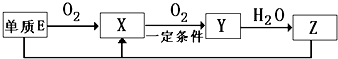
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式___________ 。
由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成C的含氧酸盐只有一种,则该含氧酸盐的化学式是______ 。
(1)已知相关物质之间存在如下变化:

①丁与乙和水反应生成戊和丙的离子方程式为
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为
(2)已知E及其化合物有以下变化:

写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式
由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成C的含氧酸盐只有一种,则该含氧酸盐的化学式是
11-12高三上·福建福州·阶段练习 查看更多[1]
(已下线)2012届福建省福州三中高三上学期第三次月考化学试卷
更新时间:2016-12-09 02:14:39
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】锑钾[Sb-K]合金、镍钴锰酸锂[LiNixCoyMn(1-x-y)O2]、磷酸铁钠[NaFePO4]分别作为钾离子电池、三元锂离子电池、钠离子电池的电极材料。这些电池成为目前实现碳中和研发的热点。请按要求回答下列问题。
(1)上述电池涉及的主族元素中,电负性最大的是_______ 。
(2)Sb是比P的周期数大2的同主族元素。基态Sb原子价电子排布式为_______ 。
(3)在回收电极材料中的Co时,测得溶液中c(Co2+)=1.0 mol·L-1,通入NH3生成 Co(OH)2沉淀,则Co2+沉淀完全时溶液的c(OH-)最小为_______ mol·L-1,(已知沉淀完全时c(Co2+)≤1.0×10-5 mol·L-1,此温度下Ksp[Co(OH)2]=4.0×10-15,溶液体积变化忽略不计)。
(4)钠离子电池电极材料制备:向含Fe3+的溶液中加入过量Na2HPO4溶液,过滤后 进一步处理得FePO4沉淀。然后将FePO4与NaI混合,在He气氛中加热,制得NaFePO4.已知常温下

 +H+ ,Ka2 =6.2×10-8,
+H+ ,Ka2 =6.2×10-8, 

 +H+Ka3 =4.8×10-13。
+H+Ka3 =4.8×10-13。
①钠离子电池工作时,NaFePO4转化为FePO4,则NaFePO4在电池_______ (填"正" 或"负”)极放电。
②NaI在制NaFePO4的反应中的作用:_______ 。
③Na2HPO4溶液中含P元素离子的浓度由大到小的顺序为_______ 。
(5)立方晶系锑钾合金的晶胞结构如图1所示,其中晶胞的一部分如图2所示。

①该晶胞中,Sb和K的原子数之比为_______ 。
②该晶体的密度为_______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)
(1)上述电池涉及的主族元素中,电负性最大的是
(2)Sb是比P的周期数大2的同主族元素。基态Sb原子价电子排布式为
(3)在回收电极材料中的Co时,测得溶液中c(Co2+)=1.0 mol·L-1,通入NH3生成 Co(OH)2沉淀,则Co2+沉淀完全时溶液的c(OH-)最小为
(4)钠离子电池电极材料制备:向含Fe3+的溶液中加入过量Na2HPO4溶液,过滤后 进一步处理得FePO4沉淀。然后将FePO4与NaI混合,在He气氛中加热,制得NaFePO4.已知常温下


 +H+ ,Ka2 =6.2×10-8,
+H+ ,Ka2 =6.2×10-8, 

 +H+Ka3 =4.8×10-13。
+H+Ka3 =4.8×10-13。①钠离子电池工作时,NaFePO4转化为FePO4,则NaFePO4在电池
②NaI在制NaFePO4的反应中的作用:
③Na2HPO4溶液中含P元素离子的浓度由大到小的顺序为
(5)立方晶系锑钾合金的晶胞结构如图1所示,其中晶胞的一部分如图2所示。

①该晶胞中,Sb和K的原子数之比为
②该晶体的密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______________________________ 。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。

①N2在0~9min内的平均反应速率v(N2)=________ mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________ (填字母代号)。
A.充入水蒸气稀释反应物 B.加入NO C.加催化剂 D.增大压强 E.降低温度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中 =
=_________ (已知:常温下H2SO3的电离平衡常数Ka1=1.0×10−2,Ka2=6.0×10−8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32−):n(HSO3−)变化关系如下表:
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):___________
a.c(Na+)=2c(SO32−)+c(HSO3−)
b.c(Na+)>c(HSO3−)>c(SO32−)>c(H+)=c(OH−)
c.c(Na+)+c(H+) =c(SO32−)+c(HSO3−)+c(OH−)
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。

①N2在0~9min内的平均反应速率v(N2)=
②第12min时改变的反应条件可能为
A.充入水蒸气稀释反应物 B.加入NO C.加催化剂 D.增大压强 E.降低温度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中
 =
=(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32−):n(HSO3−)变化关系如下表:
| n(SO32−):n(HSO3−) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32−)+c(HSO3−)
b.c(Na+)>c(HSO3−)>c(SO32−)>c(H+)=c(OH−)
c.c(Na+)+c(H+) =c(SO32−)+c(HSO3−)+c(OH−)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】高炉炼铁中常见的反应为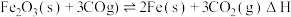
 某实验小组在实验室模拟上述反应。一定温度下,在
某实验小组在实验室模拟上述反应。一定温度下,在 盛有
盛有 粉末的恒容密闭容器中通入
粉末的恒容密闭容器中通入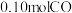 ,5min时生成
,5min时生成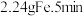 内用CO表示的平均反应速率是
内用CO表示的平均反应速率是______  ;5min时CO的转化率为
;5min时CO的转化率为______ ;若将此时反应体系中的混合气体通入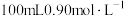 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______ 。
 上述反应的平衡常数表达式
上述反应的平衡常数表达式
______ ;判断该反应已经达到平衡状态的依据是______  填序号
填序号 。
。
 容器内固体质量保持不变
容器内固体质量保持不变  容器中气体压强保持不变
容器中气体压强保持不变


 已知上述反应的平衡常数K与温度
已知上述反应的平衡常数K与温度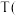 单位:
单位: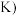 之间的关系如图所示。
之间的关系如图所示。
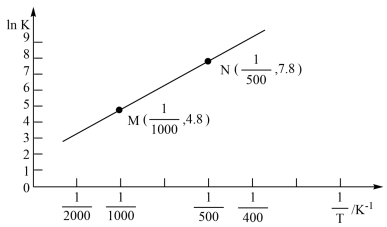
根据图象可知,该反应的平衡常随温度升高而______  填“增大”“减小”或“不变
填“增大”“减小”或“不变 。
。
 结合上述有关信息,指出两条提高CO的平衡转化率的措施:
结合上述有关信息,指出两条提高CO的平衡转化率的措施:______  写两条
写两条
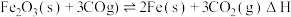
 某实验小组在实验室模拟上述反应。一定温度下,在
某实验小组在实验室模拟上述反应。一定温度下,在 盛有
盛有 粉末的恒容密闭容器中通入
粉末的恒容密闭容器中通入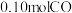 ,5min时生成
,5min时生成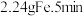 内用CO表示的平均反应速率是
内用CO表示的平均反应速率是 ;5min时CO的转化率为
;5min时CO的转化率为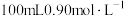 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是 上述反应的平衡常数表达式
上述反应的平衡常数表达式
 填序号
填序号 。
。 容器内固体质量保持不变
容器内固体质量保持不变  容器中气体压强保持不变
容器中气体压强保持不变

 已知上述反应的平衡常数K与温度
已知上述反应的平衡常数K与温度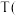 单位:
单位: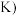 之间的关系如图所示。
之间的关系如图所示。
根据图象可知,该反应的平衡常随温度升高而
 填“增大”“减小”或“不变
填“增大”“减小”或“不变 。
。 结合上述有关信息,指出两条提高CO的平衡转化率的措施:
结合上述有关信息,指出两条提高CO的平衡转化率的措施: 写两条
写两条
您最近一年使用:0次
【推荐1】【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为________________________ ;
(2)AB32-的立体构型是____________ ,其中A原子的杂化轨道类型是___________________________ 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为________________ ,1molB22+中含有的π键数目为________________________ 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键___________________ 。
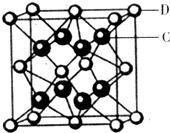
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是_________________ (只要求列算式,阿伏加德罗常数的值为NA)
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为
(2)AB32-的立体构型是
(3)A22-与B22+互为等电子体,B22+的电子式可表示为
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中_______ 区,E的核外电子排布式是_____________________ 。
(2)B、C、D第一电离能由大到小为__________________ 。
(3)A和C形成的常见分子中,中心原子的杂化方式为_________ 。
(4)1molABC分子中含有σ键数目为_________ 。
(5)与化合物BD互为等电子体的阴离子化学式为_________ 。
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________ 。
| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数为偶数 |
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中
(2)B、C、D第一电离能由大到小为
(3)A和C形成的常见分子中,中心原子的杂化方式为
(4)1molABC分子中含有σ键数目为
(5)与化合物BD互为等电子体的阴离子化学式为
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式_____________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有_____________ 个方向,原子轨道呈_____________ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为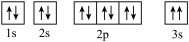 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____________ 。
(4)G位于_____________ 族_____________ 区,价电子排布式为____ 。
(5)DE3是________ 分子(填“极性”或“非极性”),中心原子的杂化方式为_________________ ,用价层电子对互斥理论推测其空间构型为_________________
(6)检验F元素的方法是____ ,请用原子结构的知识解释产生此现象的原因是_____________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是I1=738kJ/mol;I2=1451kJ/mol;I3=7733kJ/mol;I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G是第四周期中未成对电子最多的元素 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)G位于
(5)DE3是
(6)检验F元素的方法是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图___________ 。
(2)A和D形成原子个数比为1:1的物质化学式为___________ 。
(3)B元素在周期表中的位置为___________ ;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为___________ 。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)___________ 。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(6)写出A、B、D、E四种元素形成的化合物X与少量氢氧化钙溶液反应的离子方程式:___________ 。
(1)C元素的原子结构示意图
(2)A和D形成原子个数比为1:1的物质化学式为
(3)B元素在周期表中的位置为
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为
(6)写出A、B、D、E四种元素形成的化合物X与少量氢氧化钙溶液反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。回答下列问题:
(1)Y在元素周期表中的位置为_____________________________ .
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_____________________ (写化学式),非金属气态氢化物还原性最强的是_______________ (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有__________________ (写出其中两种物质的化学式)。
(4)ZX的电子式为_________________ ;ZX与水反应放出气体的化学方程式为__________________ 。
(5)用X元素的单质与Y元素的单质及由X、Y、Z三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________ ,正极__________________ 。
(1)Y在元素周期表中的位置为
(2)上述元素的最高价氧化物对应的水化物酸性最强的是
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有
(4)ZX的电子式为
(5)用X元素的单质与Y元素的单质及由X、Y、Z三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E是短周期元素,原子序数依次增大,B、C同周期,C的非金属性在元素周期表中最强,A、D同主族、隔周期,E元素原子最外层的p能级电子数是最外层的s能级电子数的一半。A、B能形成常温常压下两种液态化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列问题:
(1)甲、乙两种化合物中含有非极性共价键的物质的电子式是___________ ,C元素在元素周期表中的位置是___________ 。
(2)C和D形成的简单离子中,半径较小的是___________ (填离子符号)。
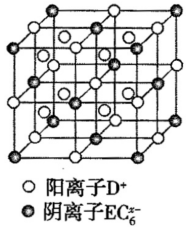
(3)将D的单质投入甲中,待D消失后再向溶液中加入E的单质,此时发生反应的化学方程式是___________ 。
(4)C、D、E可组成离子化合物,其晶胞结构如图所示,阳离子D*(用○表示)位于正方体棱的中点和正方体内部;阴离子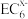 (用
(用 表示)位于该正方体的顶点和面心。该化合物的化学式是
表示)位于该正方体的顶点和面心。该化合物的化学式是___________ 。
(1)甲、乙两种化合物中含有非极性共价键的物质的电子式是
(2)C和D形成的简单离子中,半径较小的是
(3)将D的单质投入甲中,待D消失后再向溶液中加入E的单质,此时发生反应的化学方程式是
(4)C、D、E可组成离子化合物,其晶胞结构如图所示,阳离子D*(用○表示)位于正方体棱的中点和正方体内部;阴离子
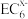 (用
(用 表示)位于该正方体的顶点和面心。该化合物的化学式是
表示)位于该正方体的顶点和面心。该化合物的化学式是
您最近一年使用:0次



