在研究金矿床物质组分的过程中,通过分析发现了Cu—Ni—Zn—Al—Fe多金属互化物。
(1)判断某种金属互化物是否属于晶体,可通过________________ 方法鉴别。已知Al的第一、第二电离能分别为578kJ/mol、1817 kJ/mol,简述I2远远大于I1的原因是________________________ 。
(2)已知Fe可与CO反应生成羰基化合物Fe(CO)n,常压下熔点为-20.3℃,沸点为103.6℃,则其属于______ 晶体。经研究发现金属原子的价电子和CO提供的电子总和为18,则n=___________ 。
(3)基态Ni原子的核外电子排布式为_______________ 。已知Ni2+、Fe2+的离子半径分别为69 pm 和78 pm,根据岩浆晶出规则,熔融的NiO和FeO岩浆在冷却过程中,NiO 先结晶。试解释其原因______________ 。
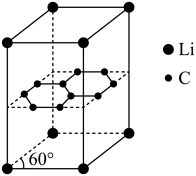
(4)Li2O晶体的晶格能可通过图(a)的born−Haber循环计算得到,其晶胞结构如图(b)所示。
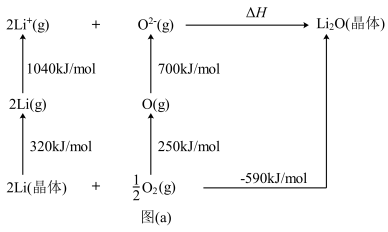

①由图(a)可知,Li原子的第一电离能为________ kJ·mol−1;由盖斯定律通过计算可得,ΔH=______ kJ·mol−1。
②观察图(b),已知晶胞参数为a nm,阿伏加德罗常数的值为NA,则晶体密度为________ g·cm-3(列式即可)。
(1)判断某种金属互化物是否属于晶体,可通过
(2)已知Fe可与CO反应生成羰基化合物Fe(CO)n,常压下熔点为-20.3℃,沸点为103.6℃,则其属于
(3)基态Ni原子的核外电子排布式为
(4)Li2O晶体的晶格能可通过图(a)的born−Haber循环计算得到,其晶胞结构如图(b)所示。


①由图(a)可知,Li原子的第一电离能为
②观察图(b),已知晶胞参数为a nm,阿伏加德罗常数的值为NA,则晶体密度为
20-21高二上·四川绵阳·期中 查看更多[2]
更新时间:2020-12-02 10:06:28
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】完成下列问题。
(1)已知气体溶解度(气体压强为 ,温度为293K,在100g水中的溶解度)数据如下表:
,温度为293K,在100g水中的溶解度)数据如下表:
结合上表信息,说明乙烷与乙炔气体的溶解度存在差异的原因:_______ 。
(2)已知乙酸( )的正交晶胞如图所示。阿伏加德罗常数为
)的正交晶胞如图所示。阿伏加德罗常数为 。
。
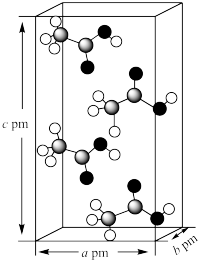
①第一电离能比C、O都大的同周期主族元素是:_______ (填元素符号)。
②乙酸晶胞的密度
_______  。
。
(3)某笼形络合物 结构中,金属离子与
结构中,金属离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,中间的空隙填充大小合适的分子(如
分子连接,中间的空隙填充大小合适的分子(如 )。其基本结构如图(H原子未画出):
)。其基本结构如图(H原子未画出):
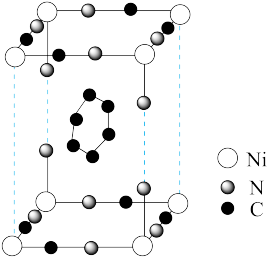
①
_______ 。
②该结构不是晶胞结构单元,理由是_______ ;
③通过分析,金属离子的配位数为_______ (填入序号)。
A.2、3 B.4、6 C.3、4 D.5、6
(1)已知气体溶解度(气体压强为
 ,温度为293K,在100g水中的溶解度)数据如下表:
,温度为293K,在100g水中的溶解度)数据如下表:| 气体 | 溶解度/g | 分子结构特点 |
| 乙烷 | 0.0062 | 中心原子 杂化,轨道半径较大,C负电性(δ-)及H正电性(δ+)不明显 杂化,轨道半径较大,C负电性(δ-)及H正电性(δ+)不明显 |
| 乙炔 | 0.117 | 中心原子sp杂化,轨道半径较小,C负电性(δ-)及H正电性(δ+)明显 |
结合上表信息,说明乙烷与乙炔气体的溶解度存在差异的原因:
(2)已知乙酸(
 )的正交晶胞如图所示。阿伏加德罗常数为
)的正交晶胞如图所示。阿伏加德罗常数为 。
。
①第一电离能比C、O都大的同周期主族元素是:
②乙酸晶胞的密度

 。
。(3)某笼形络合物
 结构中,金属离子与
结构中,金属离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,中间的空隙填充大小合适的分子(如
分子连接,中间的空隙填充大小合适的分子(如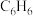 )。其基本结构如图(H原子未画出):
)。其基本结构如图(H原子未画出):
①

②该结构不是晶胞结构单元,理由是
③通过分析,金属离子的配位数为
A.2、3 B.4、6 C.3、4 D.5、6
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硼及其化合物在医疗、航空航天、超导磁体、储能材料、微波通信和动力装置上具有广泛的应用价值。
(1)固体储氢材料NH3BH3中,N原子的核外电子排布式为___________ ,B原子的杂化轨道类型为___________ ,N和B的第一电离能大小:N___________ B(填“大于”“小于”或“等于”)。
(2)氨羧基硼烷能抑制肿瘤和降低血清胆固醇,其结构与甘氨酸(NH2CH2COOH)类似,氨羧基硼烷的结构简式为___________ 。
(3)化学式为B2H6、B5H9、B6H10的硼氢化合物具有巢形结构,该硼氢化合物的通式可表示为___________ 。
(4)硼中子俘获疗法(BNCT)是一种针对脑、头、颈部肿瘤的一种新型放射疗法,该法涉及利用低能中子照射硼化合物,将13B标记的硼化合物注射到患者体内,用中子照射10B发生核裂变产生氦核(α粒子)和7Li核,裂变过程反应式为___________ 。
(5)物质的硬度和晶格焓密度(晶格焓除以物质的摩尔体积)之间的关系如图所示(碳的点代表金刚石)。氮化硼能用作高温动力装置磨料的原因是___________ 。

(6)立方氮化硼是一种用于航空航天的热绝缘体纳米材料,晶胞结构如图,晶胞参数为anm。晶体的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)固体储氢材料NH3BH3中,N原子的核外电子排布式为
(2)氨羧基硼烷能抑制肿瘤和降低血清胆固醇,其结构与甘氨酸(NH2CH2COOH)类似,氨羧基硼烷的结构简式为
(3)化学式为B2H6、B5H9、B6H10的硼氢化合物具有巢形结构,该硼氢化合物的通式可表示为
(4)硼中子俘获疗法(BNCT)是一种针对脑、头、颈部肿瘤的一种新型放射疗法,该法涉及利用低能中子照射硼化合物,将13B标记的硼化合物注射到患者体内,用中子照射10B发生核裂变产生氦核(α粒子)和7Li核,裂变过程反应式为
(5)物质的硬度和晶格焓密度(晶格焓除以物质的摩尔体积)之间的关系如图所示(碳的点代表金刚石)。氮化硼能用作高温动力装置磨料的原因是

(6)立方氮化硼是一种用于航空航天的热绝缘体纳米材料,晶胞结构如图,晶胞参数为anm。晶体的密度ρ=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示。

(1)写出基态Cu原子的核外电子排布式____ ,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____ (必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____ 。比较NH3和[Cu(NH3)4]2+中H-N-H中键角的大小:NH3_____ [Cu(NH3)4]2+(填“ ” “
” “ ”或“=”)。
”或“=”)。
(4)已知H2O2的结构如图:
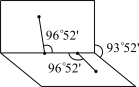
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______ 。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
结合数据说明CO比N2活泼的原因:_________ 。

(1)写出基态Cu原子的核外电子排布式
(2)写出胆矾晶体中水合铜离子的结构简式
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式
 ” “
” “ ”或“=”)。
”或“=”)。(4)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
| A—B | A=B | A=B | |
| CO | 357.7 | 798.9 | 1 071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;B元素原子中的未成对电子数为_______________________ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______ ;A与B形成的AB2-的空间构型为___________________________ 。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________________ (用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________ ;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________ ;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________ 。
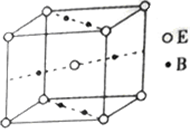
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为__________________________ 。
(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
(3)A、B、C三种元素的第一电离能从大到小的顺序为
(4)基态F3+的核外电子排布式是
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
【推荐2】(1)卤族元素组成的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识它们。
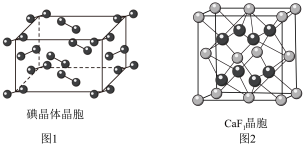
①如图1为碘晶体的晶胞结构。有关说法正确的是_________ (填序号)。
a.平均每个晶胞中有4个碘分子
b.平均每个晶胞中有4个碘原子
c.碘晶体为无限延伸的空间结构,是原子晶体
d.碘晶体中存在的相互作用有非极性键和范德华力
②已知CaF2晶胞(图2)的密度为ρ g/cm3,NA表示阿伏加 德罗常数的值,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量可表示为_________________ 。
(2)以MgCl2为原料用电解熔融盐法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有_______________ 。
(3)有研究表明,化合物X可用于研究模拟酶,当结合 或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
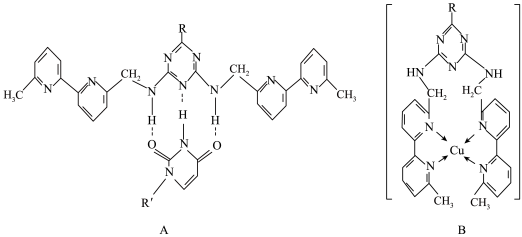
①A中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有_________ 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较A和B中微粒间相互作用力的差异:________________ 。

①如图1为碘晶体的晶胞结构。有关说法正确的是
a.平均每个晶胞中有4个碘分子
b.平均每个晶胞中有4个碘原子
c.碘晶体为无限延伸的空间结构,是原子晶体
d.碘晶体中存在的相互作用有非极性键和范德华力
②已知CaF2晶胞(图2)的密度为ρ g/cm3,NA表示阿伏加 德罗常数的值,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量可表示为
(2)以MgCl2为原料用电解熔融盐法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有
(3)有研究表明,化合物X可用于研究模拟酶,当结合
 或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
①A中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有
②微粒间的相互作用包括化学键和分子间相互作用,比较A和B中微粒间相互作用力的差异:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某中学同学在做铜与浓硫酸(装置如图)的反应实验时,发现有如下的反应现象:加热初期,铜丝表面变黑;继续加热,有大量气泡产生,品红溶液褪色,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成;再加热,试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多;冷却,静置,将试管中液体倒入另一支盛水试管中,管壁发汤,溶液略带蓝色,将灰白色固体倒入水中,形成蓝色溶液。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的______ 性,NaOH溶液的作用是______ 。
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:______ 。
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:______ 。
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:______ 。溶液的蓝色变浅,灰白色沉淀增多,这现象体现浓硫酸的______ 性。
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有______ 。
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:______ 。
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 现象 | ||
| I组 | 取灼烧后的铜丝 | 溶液变蓝 |
| Ⅱ组 | 直接取其铜丝(表面有聚四氯乙烯薄膜) | 溶液变成墨绿色 |
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】钒和钼均属于高熔点稀有金属,可以作为钢合金的主要添加元素, 不溶于水,能溶于氨水和强碱,形成铝酸盐,即使低于熔点也能升华。一种从含钒石油废催化剂(主要成分是
不溶于水,能溶于氨水和强碱,形成铝酸盐,即使低于熔点也能升华。一种从含钒石油废催化剂(主要成分是 、
、 和
和 等)中提取钒、钼的工艺如下:
等)中提取钒、钼的工艺如下:
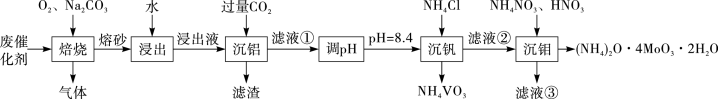
回答下列问题:
(1)钒在周期表中位置为___________ 。
(2)“焙烧”过程中 先转化为
先转化为 ,最终转化为
,最终转化为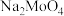 ,写出该过程中钼元素发生转化的化学方程式
,写出该过程中钼元素发生转化的化学方程式___________________________ ;“焙烧”过程中,温度对钒、钼转化率影响如图所示,“焙烧”的适宜温度是___________ ,某化学活动小组在实验室模拟工业焙烧步骤,应选用的仪器有酒精喷灯、三脚架、铁棒、泥三角、坩埚钳和___________ 。

(3)“浸出”所得浸出液中所含阴离子主要是 和
和___________ 。
(4)写出“沉铝”时反应的离子方程式___________ 。
(5)“沉钒”操作中,pH控制在8.4沉钒率较高,若pH过高,沉钒率降低,原因是_______________ 。
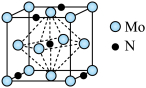
(6)“沉钼”得到的四钼酸铵在一定条件下反应可制取氮化钼,该氮化物为立方晶胞结构(如图所示)。则该晶体的化学式为___________ ,钼原子的配位数是___________ 个。
 不溶于水,能溶于氨水和强碱,形成铝酸盐,即使低于熔点也能升华。一种从含钒石油废催化剂(主要成分是
不溶于水,能溶于氨水和强碱,形成铝酸盐,即使低于熔点也能升华。一种从含钒石油废催化剂(主要成分是 、
、 和
和 等)中提取钒、钼的工艺如下:
等)中提取钒、钼的工艺如下:
回答下列问题:
(1)钒在周期表中位置为
(2)“焙烧”过程中
 先转化为
先转化为 ,最终转化为
,最终转化为 ,写出该过程中钼元素发生转化的化学方程式
,写出该过程中钼元素发生转化的化学方程式
(3)“浸出”所得浸出液中所含阴离子主要是
 和
和(4)写出“沉铝”时反应的离子方程式
(5)“沉钒”操作中,pH控制在8.4沉钒率较高,若pH过高,沉钒率降低,原因是
(6)“沉钼”得到的四钼酸铵在一定条件下反应可制取氮化钼,该氮化物为立方晶胞结构(如图所示)。则该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】材料是入类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题。
(1)B和Ni均为新材料的主角。
①按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BBr3。杂化前,处于激发态的B原子的价电子轨道表示式为_____ (填编号)。
A. B.
B.
C.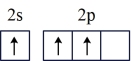 D.
D.
②Ni(CO)4常温下呈液态,其分子空间构型为正四面体形。其易溶CCl4、苯等有机溶剂的原因是_____ 。
(2)亚铁氰化钾具有防止食盐结块、保持食盐松散等作用,其化学式为K4[Fe(CN)6],所含元素电负性由大到小的顺序为_____ ,lmolK4[Fe(CN)6]含有σ键的物质的量为_____ 。
(3)铀氮化合物是核燃料循环系统中的重要物质。
已知3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。反应所得的气态产物中属于非极性分子的有
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。反应所得的气态产物中属于非极性分子的有_____ (填化学式);反应中断裂的化学键有_____ 。(填编号)。
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(4)某锂电池的负极材料是锂原子嵌入石墨烯层间,其晶胞结构(底边为平行四边形)如图所示。
该晶体的化学式为____ ;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为_____ g•cm-3(NA表示阿伏加德罗常数,列出计算表达式即可)。
(1)B和Ni均为新材料的主角。
①按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BBr3。杂化前,处于激发态的B原子的价电子轨道表示式为
A.
 B.
B.
C.
 D.
D.
②Ni(CO)4常温下呈液态,其分子空间构型为正四面体形。其易溶CCl4、苯等有机溶剂的原因是
(2)亚铁氰化钾具有防止食盐结块、保持食盐松散等作用,其化学式为K4[Fe(CN)6],所含元素电负性由大到小的顺序为
(3)铀氮化合物是核燃料循环系统中的重要物质。
已知3(NH4)4[UO2(CO3)3]
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。反应所得的气态产物中属于非极性分子的有
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。反应所得的气态产物中属于非极性分子的有a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(4)某锂电池的负极材料是锂原子嵌入石墨烯层间,其晶胞结构(底边为平行四边形)如图所示。

该晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜及其化合物在生产和生活中有着广泛的应用。请回答下列问题:
(1)基态铜原子有_________ 种运动状态不同的电子,其价层电子排布式为________ 。
(2)Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如下实验。
① 晶体中H2O的中心原子杂化轨道类型为
晶体中H2O的中心原子杂化轨道类型为___________ 。
②该实验条件下,Cu2+与NH3的结合能力_______________ (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力,
③加入乙醇有晶体析出的原因为____________ 。
④H—N—H键角大小:
_____________ NH3(填“>”、“=”或“<”),其原因是___________ 。
⑤NH3能与Cu2+形成 ,而NF3不能,其原因是
,而NF3不能,其原因是________________ 。
(3)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为 。(1pm=10-10cm)
。(1pm=10-10cm)__________ 。
②Cu2S晶体的密度为
__________________ g·cm-3(列出计算式即可)。
(1)基态铜原子有
(2)Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如下实验。
| 序号 | 实验步骤 | 实验现象或结论 |
| ⅰ | 向CuSO4溶液中逐滴加入氨水至过量 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
| ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
| ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为 |
| ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
 晶体中H2O的中心原子杂化轨道类型为
晶体中H2O的中心原子杂化轨道类型为②该实验条件下,Cu2+与NH3的结合能力
③加入乙醇有晶体析出的原因为
④H—N—H键角大小:

⑤NH3能与Cu2+形成
 ,而NF3不能,其原因是
,而NF3不能,其原因是(3)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为
 。(1pm=10-10cm)
。(1pm=10-10cm)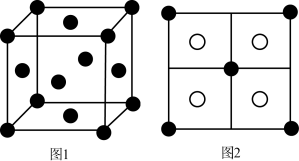
②Cu2S晶体的密度为
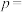
您最近一年使用:0次



