将一定量的氯气通入30 mL浓度为10 mol/L的氢氧化钠浓溶液中,加热少许时间后恰好完全反应,形成了NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气为0.15mol |
| B.n(NaCl):n(NaClO):n(NaClO3)可能为10:3:1 |
| C.Cl2与NaOH溶液反应的产物会随反应条件的改变而改变 |
| D.溶液中氯离子的物质的量取值范围是0.15 mol < n(Cl-) < 0. 25 mol |
19-20高一·浙江·阶段练习 查看更多[6]
(已下线)【浙江新东方】双师(31)(已下线)【浙江新东方】63(已下线)【浙江新东方】在线化学23天津市静海区第一中学2020-2021学年高一上学期期末考试化学试题浙江省瑞安中学2020-2021学年高一下学期期中考试化学试题天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题
更新时间:2020-12-05 12:26:30
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】在一定条件下PbO2与Cr3+反应,产物是Cr2O 和Pb2+,则与1个Cr3+反应所需PbO2的个数为( )
和Pb2+,则与1个Cr3+反应所需PbO2的个数为( )
 和Pb2+,则与1个Cr3+反应所需PbO2的个数为( )
和Pb2+,则与1个Cr3+反应所需PbO2的个数为( )| A.3 | B.1.5 | C.1 | D.0.75 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】14g铜金合金与足量的某浓度HNO3反应,将产生的气体用2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
| A.9.6g | B.6.4g | C.12.8g | D.1.6g |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】实验室用MnO2与浓盐酸制备氯气,下列装置不正确的是
A.反应装置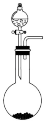 | B.除杂装置 |
C.气体收集装置 | D.尾气吸收装置 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用,它的有效成分是下列物质的一种,这种物质是
| A.Ca(ClO)2 | B.Na2O2 | C.H2O2 | D.NaClO |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】NA代表阿伏加德罗常数,下列说法正确的是
| A.标准状况下,22.4L由氢气和氧气组成的混合气体中,所含有的分子总数为NA |
| B.标准状况下,224 L氦气中含原子数为2NA |
| C.1 mol氯气与足量NaOH溶液反应,转移的电子数为2NA |
D.1 molCH 碳正离子中含有电子数为10 NA 碳正离子中含有电子数为10 NA |
您最近一年使用:0次



