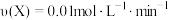下列说法中正确的是
①活化分子间的碰撞不一定能发生化学反应
②普通分子间的碰撞可能发生化学反应
③增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多
④催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
⑤有气体参加的化学反应,若增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
①活化分子间的碰撞不一定能发生化学反应
②普通分子间的碰撞可能发生化学反应
③增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多
④催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
⑤有气体参加的化学反应,若增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
| A.①③④ | B.②③⑤ | C.③④ | D.④⑤ |
更新时间:2020-12-14 20:14:16
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
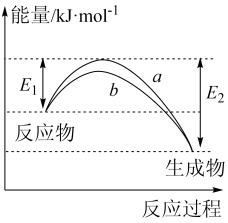
【推荐1】已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I1、I2表示中间产物。下列说法正确的是
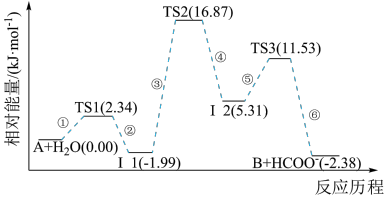

| A.化合物A与H2O之间的碰撞均为有效碰撞 |
| B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1 |
| C.改用高活性催化剂,其反应历程一定与上图相同 |
| D.该反应的速率快慢取决于步骤③ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】利用CH4能消除有害气体NO,其反应原理为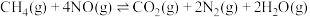
 ,一定温度下,该反应在密闭容器中达到平衡状态。下列说法正确的是
,一定温度下,该反应在密闭容器中达到平衡状态。下列说法正确的是
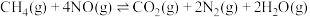
 ,一定温度下,该反应在密闭容器中达到平衡状态。下列说法正确的是
,一定温度下,该反应在密闭容器中达到平衡状态。下列说法正确的是| A.加入催化剂,活化分子百分数不变 |
| B.恒容下,再通入适量CH4,CH4的平衡转化率减小 |
| C.适当增大压强,化学平衡常数增大 |
| D.升高温度,逆反应速率增大,正反应速率减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是| A.达到化学平衡时,5v正(O2)= 4v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| D.催化剂降低反应活化能,增大单位体积内活化分子百分数,从而增大反应速率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】对于反应: ,在密闭容器中进行,下列条件能加快反应速率的是
,在密闭容器中进行,下列条件能加快反应速率的是
 ,在密闭容器中进行,下列条件能加快反应速率的是
,在密闭容器中进行,下列条件能加快反应速率的是| A.增大体积使压强减小 | B.体积不变,充入氦气使压强增大 |
C.体积不变,充入 使压强增大 使压强增大 | D.使总压强不变,充入氖气 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】合成氨反应为:
 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是

 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是| A.催化剂增大了正、逆反应的活化能 | B.升高温度,该反应的平衡常数增大 |
| C.正反应的活化能小于逆反应的活化能 | D.升温或增压均可提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】德国化学家 F.Haber 利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用 、
、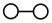 、
、 分别表示N2、H2、NH3,下列说法不正确的是
分别表示N2、H2、NH3,下列说法不正确的是
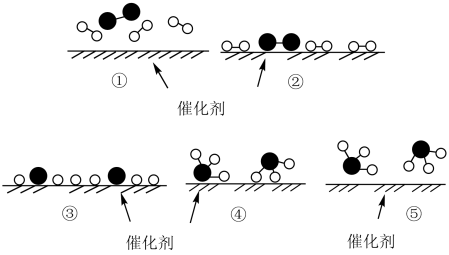
 、
、 、
、 分别表示N2、H2、NH3,下列说法不正确的是
分别表示N2、H2、NH3,下列说法不正确的是

| A.过程②为反应物吸附在催化剂表面,没有发生化学变化 |
| B.合成氨反应中,反应物断键吸收的总能量大于生成物形成新键所释放的总能量 |
| C.过程④为放热过程 |
| D.使用催化剂,能加快合成氨反应的速率 |
您最近一年使用:0次

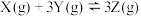
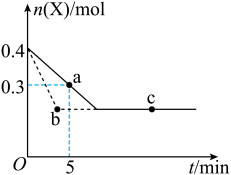
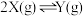 (正反应放热),X的物质的量
(正反应放热),X的物质的量 随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述不正确的是
随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述不正确的是