铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。

(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_____ 区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+,从离子的价电子排布式角度解释Mn2+与Fe2+还原能力的差别:_____ 。Mn2+的半径_____ Fe3+的半径。(填“>”、“<”或“=”)
(3)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_____ :[Fe(SCN(H2O)5]2+中Fe3+的配位数为_____ ,H2O中氧原子的杂化方式为_____ 。
(4)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H5﹣)配体形成的夹心型分子(如图a所示)。已知大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则C5H 的大π键表示为
的大π键表示为_____ 。二茂铁是黄色针状晶体,熔点173℃(在100℃时开始升华),沸点249℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是_____ 。(填标号)
A.配位键
B.氢键
C.σ键
D.范德华力
(5)一种含有Fe、Cu、S三种元素的矿物的晶胞(如图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_____ 。如果晶胞的底面边长为Apm,高为Cpm,阿伏加德罗常数为NA,则该晶体的密度为_____ g/cm3。(写出表达式)

(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+,从离子的价电子排布式角度解释Mn2+与Fe2+还原能力的差别:
(3)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为
(4)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H5﹣)配体形成的夹心型分子(如图a所示)。已知大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则C5H
 的大π键表示为
的大π键表示为A.配位键
B.氢键
C.σ键
D.范德华力
(5)一种含有Fe、Cu、S三种元素的矿物的晶胞(如图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为
更新时间:2020-12-14 19:27:19
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
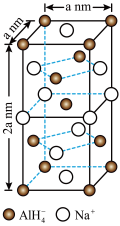
【推荐1】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。
(1)基态Ti原子的价电子轨道表示式 为_______ 。
(2)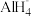 的空间构型为
的空间构型为_______________ ,中心原子Al的轨道杂化方式为_________ ;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式 为_________________ (标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于_______ 晶体,其电子式为_____________ 。
(5)NaAlH4晶体中,与Na+紧邻且等距的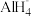 有
有_______ 个;NaAlH4晶体的密度为_________ g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为___________ (填化学式)。
(6)NaAlH4的释氢机理为:每3个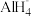 中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为______________________________________________ 。

(1)基态Ti原子的
(2)
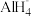 的空间构型为
的空间构型为(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于
(5)NaAlH4晶体中,与Na+紧邻且等距的
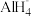 有
有(6)NaAlH4的释氢机理为:每3个
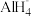 中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为___ ,基态镍原子中核外电子占据最高能层的符号为__ 。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___ 晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___ ,写出与配体互为等电子体的分子___ 。
(3)与硫同族的硒元素有两种常见的二元含氧酸分别为___ 、___ (填化学式)。
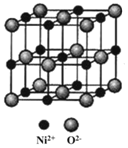
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的正八面体空隙中,已知晶胞参数为apm,阿伏加德罗常数为NA,NiO晶体的密度为____ g/cm3(列出计算式 。
。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
(3)与硫同族的硒元素有两种常见的二元含氧酸分别为
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的正八面体空隙中,已知晶胞参数为apm,阿伏加德罗常数为NA,NiO晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______ ,铬元素在周期表中______ 区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______ 杂化。
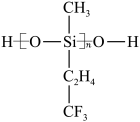
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______ 填元素符号
②根据价层电子对互斥理论,预测ClO3-的空间构型为______ 形,写出一个ClO3-的等电子体的化学符号______ 。
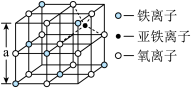
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____ (填“是”或“否”);该立方体是不是Fe3O4的晶胞?______ (填“是”或“否”);立方体中铁离子处于氧离子围成的_______ (填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________ g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】软包电池(水系 )具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
)具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
回答下列问题:
(1)基态 原子核外电子排布式为
原子核外电子排布式为_______ ;原子中运动的电子有两种相反的自旋状态,若一种自旋状态用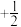 表示,则与之相反的用
表示,则与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其核外电子自旋磁量子数的代数和为
原子,其核外电子自旋磁量子数的代数和为_______ 。
(2)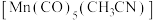 是锰的一种配合物。配体
是锰的一种配合物。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是_______ (填元素符号),其能量最高的电子所在的能级符号为_______ ,配合物中心原子的配位数是_______ 。
(3) 软包电池的关键组件
软包电池的关键组件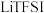 结构如图所示。
结构如图所示。

①其中S原子的杂化轨道类型为_______ 。
②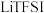 中存在的作用力为
中存在的作用力为_______ (填标号)。
A.金属键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
③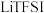 中第二周期非金属元素的第一电离能由大到小的顺序为
中第二周期非金属元素的第一电离能由大到小的顺序为_______ ,原因是_______ 。
(4) 掺杂的氮化钛晶胞结构如图所示。距离
掺杂的氮化钛晶胞结构如图所示。距离 最近的
最近的 有
有_______ 个,已知阿伏加德罗常数的值为 ,若晶体的密度为
,若晶体的密度为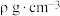 ,该晶胞的边长为
,该晶胞的边长为_______ cm(列出算式)。

 )具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
)具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。回答下列问题:
(1)基态
 原子核外电子排布式为
原子核外电子排布式为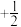 表示,则与之相反的用
表示,则与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其核外电子自旋磁量子数的代数和为
原子,其核外电子自旋磁量子数的代数和为(2)
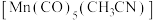 是锰的一种配合物。配体
是锰的一种配合物。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是(3)
 软包电池的关键组件
软包电池的关键组件 结构如图所示。
结构如图所示。
①其中S原子的杂化轨道类型为
②
 中存在的作用力为
中存在的作用力为A.金属键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键③
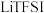 中第二周期非金属元素的第一电离能由大到小的顺序为
中第二周期非金属元素的第一电离能由大到小的顺序为(4)
 掺杂的氮化钛晶胞结构如图所示。距离
掺杂的氮化钛晶胞结构如图所示。距离 最近的
最近的 有
有 ,若晶体的密度为
,若晶体的密度为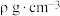 ,该晶胞的边长为
,该晶胞的边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】金属及其合金应用广泛。
(1)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________ 。
(2)下图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b点对应的元素为______ (填元素符号)。

(3)乙醇可被三氧化铬(CrO3)氧化为乙醛(CH3CHO)。乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是_____________________ 。
(4)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是_________________ 。
(5)元素Al与元素Fe形成某种晶体结构如图所示。若晶胞的边长为a nm,则合金的密度为_______ g·cm—3。

(1)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
(2)下图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b点对应的元素为

(3)乙醇可被三氧化铬(CrO3)氧化为乙醛(CH3CHO)。乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是
(4)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是
(5)元素Al与元素Fe形成某种晶体结构如图所示。若晶胞的边长为a nm,则合金的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】 是重要的金属元素,回答下列问题:
是重要的金属元素,回答下列问题:
(1)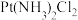 有顺式和反式两种结构,则
有顺式和反式两种结构,则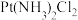 分子的空间构型为
分子的空间构型为_______ (填“平面四边”或“正四面体”)形,其中心原子的杂化方式推断合理的是_______ (填标号)。
A. B.
B. C.
C. D.
D.
(2)写出 的等电子体:
的等电子体:_______ (写出一种即可)。
(3)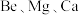 均为第ⅡA族元素,氯化铍晶体易吸湿、水解、升华,可溶于有机溶剂。一定条件下有下列存在形式:
均为第ⅡA族元素,氯化铍晶体易吸湿、水解、升华,可溶于有机溶剂。一定条件下有下列存在形式:
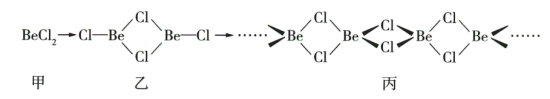
①氯化铍晶体的晶体类型是_______ ,甲的空间构型是_______ 。
②乙中 的杂化轨道类型是
的杂化轨道类型是_______ ,从化学键角度分析形成丙的原因:_______ 。
 是重要的金属元素,回答下列问题:
是重要的金属元素,回答下列问题:(1)
 有顺式和反式两种结构,则
有顺式和反式两种结构,则 分子的空间构型为
分子的空间构型为A.
 B.
B. C.
C. D.
D.
(2)写出
 的等电子体:
的等电子体:(3)
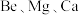 均为第ⅡA族元素,氯化铍晶体易吸湿、水解、升华,可溶于有机溶剂。一定条件下有下列存在形式:
均为第ⅡA族元素,氯化铍晶体易吸湿、水解、升华,可溶于有机溶剂。一定条件下有下列存在形式:
①氯化铍晶体的晶体类型是
②乙中
 的杂化轨道类型是
的杂化轨道类型是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】有机阳离子是一类带正电荷的粒子,如 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。
(1)C原子价电子的轨道表示式为________ 。第一电离能N____ O(填“>”或“<”),原因是__________ 。
(2) 中N的杂化方式为
中N的杂化方式为____________________ 。从化学键的角度描述由 (甲胺)形成
(甲胺)形成 的过程
的过程____________________ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为__________ 。
(4)某材料中含有机阳离子,其晶胞结构如图所示。
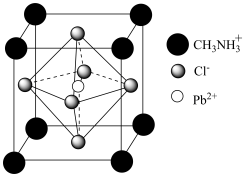
①化学式为____________________ ;其中 周围最临近的
周围最临近的 个数为
个数为__________ 。
②已知晶体密度为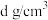 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为______  。
。
 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。(1)C原子价电子的轨道表示式为
(2)
 中N的杂化方式为
中N的杂化方式为 (甲胺)形成
(甲胺)形成 的过程
的过程(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为(4)某材料中含有机阳离子,其晶胞结构如图所示。

①化学式为
 周围最临近的
周围最临近的 个数为
个数为②已知晶体密度为
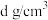 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】【化学一选修3:物质结构与性质】
磷及其化合物在工农业生产上应用非常广泛。
(1)磷元素位于周期表的_______ 区,基态磷原子价层电子排布图________ ,最高能层符号________ 。
(2)磷的三种同素异形体的结构如下图所示。

① 三种同素异形体中能导电的是_______ (填名称)。
②白磷易溶于CS2,其原因是___________ 。
(3)磷酸与Fe3+可形成H3[Fe(PO4)2],Fe、P、O电负性由大到小的顺序是________ 。与PO43-空间构型相同的分子和阴离子分别是________ (各举1例)。
(4)噻替哌的结构简式如右图所示,其中氮原子的杂化轨道类型为_______ ,1mol噻替哌中含有的σ键数目为______ 。

(5)磷化铟( InP)是一种半导体材料,可用于光纤通信技术,其晶胞结构如图所示。

①结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,晶胞中P原子的坐标参数分别有:P (0,0,0),P( ,0,
,0, );P(0,
);P(0, ,
, )等,则距离上述三个P原子最近且等离的In原子的坐标参数为
)等,则距离上述三个P原子最近且等离的In原子的坐标参数为_____ 。
②已知晶胞参数a=0.587 m,则InP晶体的密度为______ g/cm3。
磷及其化合物在工农业生产上应用非常广泛。
(1)磷元素位于周期表的
(2)磷的三种同素异形体的结构如下图所示。

① 三种同素异形体中能导电的是
②白磷易溶于CS2,其原因是
(3)磷酸与Fe3+可形成H3[Fe(PO4)2],Fe、P、O电负性由大到小的顺序是
(4)噻替哌的结构简式如右图所示,其中氮原子的杂化轨道类型为

(5)磷化铟( InP)是一种半导体材料,可用于光纤通信技术,其晶胞结构如图所示。

①结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,晶胞中P原子的坐标参数分别有:P (0,0,0),P(
 ,0,
,0, );P(0,
);P(0, ,
, )等,则距离上述三个P原子最近且等离的In原子的坐标参数为
)等,则距离上述三个P原子最近且等离的In原子的坐标参数为②已知晶胞参数a=0.587 m,则InP晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铬锆铜(CuCrZr)合金具有优良性能,广泛应用于机械制造工业的焊接。已知锆(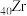 )位于第ⅣB族,根据要求回答下列问题:
)位于第ⅣB族,根据要求回答下列问题:
(1)铜元素在元素周期表的位置为_______ ,基态Cr原子的价电子排布式为_______ 。
(2)形成铬锆铜合金的元素中,基态原子的第一电离能最大的是_______ (填元素符号)。下表是Fe与Cu的部分电离能数据, (Cu)大于
(Cu)大于 (Fe)的主要原因是
(Fe)的主要原因是_______ 。
(3)配合物 中的配体是
中的配体是_______ ,该配合物中N、O的杂化轨道类型分别为_______ 、_______ 。
(4)硝酸铜[ ]是一种重要的工业原料,写出其阴离子(
]是一种重要的工业原料,写出其阴离子( )的空间构型:
)的空间构型:_______ 。
(5)铜与氯形成晶体的晶胞如图所示,该晶体的化学式为_______ ;已知晶胞边长为a nm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为_______  。
。

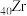 )位于第ⅣB族,根据要求回答下列问题:
)位于第ⅣB族,根据要求回答下列问题:(1)铜元素在元素周期表的位置为
(2)形成铬锆铜合金的元素中,基态原子的第一电离能最大的是
 (Cu)大于
(Cu)大于 (Fe)的主要原因是
(Fe)的主要原因是| 元素 | Fe | Cu |
第一电离能 | 759 | 746 |
第二电离能 | 1561 | 1958 |
(3)配合物
 中的配体是
中的配体是(4)硝酸铜[
 ]是一种重要的工业原料,写出其阴离子(
]是一种重要的工业原料,写出其阴离子( )的空间构型:
)的空间构型:(5)铜与氯形成晶体的晶胞如图所示,该晶体的化学式为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近一年使用:0次



