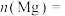Ⅰ.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是____________________ 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________ 。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00 g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是_______________________________________ 。
②原样品中高铁酸钾的质量分数为______________ 。
Ⅲ.A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):A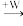 B
B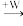 C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)若将标准状况下2.24 L的W通入150 mL 1 mol·L-1的A溶液中,充分反应。总反应的离子方程式为______________________________________________ 。
(2)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2 mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为__________ 。
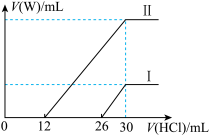
Ⅳ.简述检验某液态卤代烃中是否含有氯元素的方法:_______________________ 。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00 g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是
②原样品中高铁酸钾的质量分数为
Ⅲ.A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):A
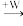 B
B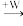 C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。(1)若将标准状况下2.24 L的W通入150 mL 1 mol·L-1的A溶液中,充分反应。总反应的离子方程式为
(2)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2 mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为

Ⅳ.简述检验某液态卤代烃中是否含有氯元素的方法:
更新时间:2020-12-16 15:17:32
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】某干燥白色固体可能含有 ,
, 、NaOH中的几种,取一定质量的该固体加蒸馏水配制100mL溶液,并向该溶液中滴加0.5
、NaOH中的几种,取一定质量的该固体加蒸馏水配制100mL溶液,并向该溶液中滴加0.5 的盐酸,得到
的盐酸,得到 体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:

(1)产生的 的物质的量为
的物质的量为_______ mol,AB段发生反应的化学方程式为_______ 。
(2)若白色固体由0.02mol 和x mol
和x mol 组成,则x=
组成,则x=_______ ,
_______ ,
_______ 。
(3)若白色固体由 和NaOH组成,
和NaOH组成,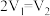 ,则
,则 与NaOH溶于水后发生反应的离子方程式为
与NaOH溶于水后发生反应的离子方程式为_______ ,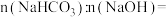
_______ 。
(4)若白色固体只由NaOH和 组成,且
组成,且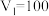 ,
,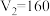 ,则
,则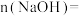
_______ mol,原100mL溶液中的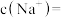
_______  。
。
 ,
, 、NaOH中的几种,取一定质量的该固体加蒸馏水配制100mL溶液,并向该溶液中滴加0.5
、NaOH中的几种,取一定质量的该固体加蒸馏水配制100mL溶液,并向该溶液中滴加0.5 的盐酸,得到
的盐酸,得到 体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
(1)产生的
 的物质的量为
的物质的量为(2)若白色固体由0.02mol
 和x mol
和x mol 组成,则x=
组成,则x=

(3)若白色固体由
 和NaOH组成,
和NaOH组成,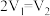 ,则
,则 与NaOH溶于水后发生反应的离子方程式为
与NaOH溶于水后发生反应的离子方程式为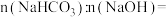
(4)若白色固体只由NaOH和
 组成,且
组成,且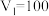 ,
,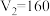 ,则
,则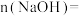
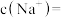
 。
。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再产生CO2气体为止,在此过程中,溶液中的碳酸氢根离子浓度的变化是___ 。
A.先变大后变小 B.先变小后变大 C.一直变小 D.保持不变
(2)有含0.2molNa2CO3和含0.3molHCl的两种溶液中:①将Na2CO3溶液逐滴加入HCl溶液中;②将HCl溶液逐滴加入Na2CO3溶液中。①②两种操作生成的CO2之比为___ 。
(3)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理完成下列各小题:
①取A与足量的盐酸反应:若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,则A的组成可能有___ 种。若固体混合物A的质量m(A)为定值,生成气体的量为定值,则A的可能组成是(填写化学式):___ 、___ ;___ 、___ 。(可以不填满)
②若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0g,则混合固体A的总物质的量是___ mol。
A.先变大后变小 B.先变小后变大 C.一直变小 D.保持不变
(2)有含0.2molNa2CO3和含0.3molHCl的两种溶液中:①将Na2CO3溶液逐滴加入HCl溶液中;②将HCl溶液逐滴加入Na2CO3溶液中。①②两种操作生成的CO2之比为
(3)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理完成下列各小题:
①取A与足量的盐酸反应:若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,则A的组成可能有
②若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0g,则混合固体A的总物质的量是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】许多钠的化合物的水溶液呈碱性,这些化合物之间往往可以相互转化。
(1)写出 的电子式
的电子式___________ ; 所含化学键的类型有
所含化学键的类型有___________ (填写下列字母)。
a.极性共价键 b.非极性共价键 c.离子键 d.金属键
(2) 金属钠完全氧化为
金属钠完全氧化为 的焓变为
的焓变为 ,而完全氧化为
,而完全氧化为 的焓变为
的焓变为 ,则
,则
___________  (填“>”、“<”或“=”)。如果以
(填“>”、“<”或“=”)。如果以 为原料制备
为原料制备 固体,样品往往混有一定量的
固体,样品往往混有一定量的 。可以通过测定固体样品加热前后的质量差来测定该样品的纯度。
。可以通过测定固体样品加热前后的质量差来测定该样品的纯度。
(3)该固体样品应在___________ (填仪器名称)中加热至恒重。该过程主要发生的化学方程式为___________ 。
(4)对某一样品做四组平行实验,数据结果如下:
则该样品中 质量分数为
质量分数为___________ (表示成百分数,精确到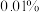 )。
)。
(5)若 质量分数标准值为
质量分数标准值为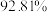 ,则上述实验中可能存在的问题有
,则上述实验中可能存在的问题有___________ (填写下列字母)
a.盛放样品的容器有受热分解杂质 b.盛放样品的容器有热稳定杂质
c.加热前洗净的容器未完全干燥 d.样品在加热后冷却时未放置于干燥器
e.加热时有样品溅出 f.固体样品未充分受热,反应进行不完全
(1)写出
 的电子式
的电子式 所含化学键的类型有
所含化学键的类型有a.极性共价键 b.非极性共价键 c.离子键 d.金属键
(2)
 金属钠完全氧化为
金属钠完全氧化为 的焓变为
的焓变为 ,而完全氧化为
,而完全氧化为 的焓变为
的焓变为 ,则
,则
 (填“>”、“<”或“=”)。如果以
(填“>”、“<”或“=”)。如果以 为原料制备
为原料制备 固体,样品往往混有一定量的
固体,样品往往混有一定量的 。可以通过测定固体样品加热前后的质量差来测定该样品的纯度。
。可以通过测定固体样品加热前后的质量差来测定该样品的纯度。(3)该固体样品应在
(4)对某一样品做四组平行实验,数据结果如下:
| 所测物理量 | 第一组 | 第二组 | 第三组 | 第四组 |
| 容器质量/g | 17.221 | 18.565 | 18.652 | 17.094 |
| 加热前容器与样品质量/g | 24.864 | 26.800 | 26.935 | 24.338 |
| 恒重后容器与样品质量/g | 22.209 | 23.936 | 23.992 | 21.823 |
 质量分数为
质量分数为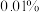 )。
)。(5)若
 质量分数标准值为
质量分数标准值为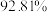 ,则上述实验中可能存在的问题有
,则上述实验中可能存在的问题有a.盛放样品的容器有受热分解杂质 b.盛放样品的容器有热稳定杂质
c.加热前洗净的容器未完全干燥 d.样品在加热后冷却时未放置于干燥器
e.加热时有样品溅出 f.固体样品未充分受热,反应进行不完全
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH 、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。
、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。
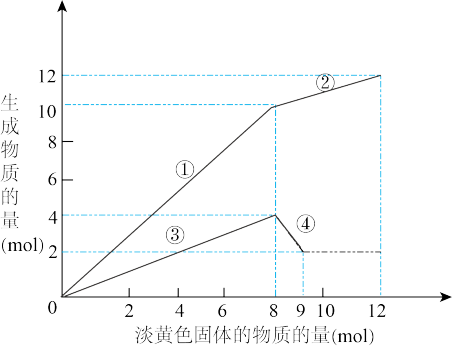
(1)写出反应②和④的离子方程式
②_________________ 。
④__________________ 。
(2)溶液中含有的离子是__________ ,它们的物质的量浓度之比为_________ 。
 、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。
、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。
(1)写出反应②和④的离子方程式
②
④
(2)溶液中含有的离子是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
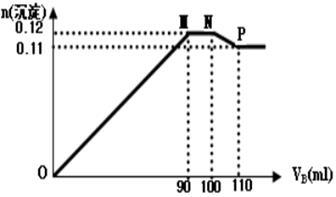
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)____________________
(2)从90 mL至100 mL之间加入10 mL B溶液时发生的离子反应方程式①_________________ ;②________________ ;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为________________ 。
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为_____________ mol/L;
A溶液中FeCl3物质的量浓度为______________ mol/L。

(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)
(2)从90 mL至100 mL之间加入10 mL B溶液时发生的离子反应方程式①
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为
A溶液中FeCl3物质的量浓度为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
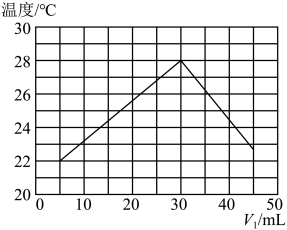
【推荐1】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________ (填“高于”、“低于”或“等于”)22℃,判断的依据是_______ 。
(2)由题干及图形可知:V1∶V2=________ 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______ 搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________ 。
(1)研究小组做该实验时环境温度
(2)由题干及图形可知:V1∶V2=
(3)实验时将酸碱在简易量热计中混合,并用

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为___________ ,该样品中Na2S2O5的残留量为___________ g·L-1(以SO2计)。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】二氯异氰尿酸钠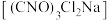 是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的
是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的 溶液和
溶液和 固体,在
固体,在 时反应制备二氯异氰尿酸钠。某实验小组通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
时反应制备二氯异氰尿酸钠。某实验小组通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理: ,
, ,
, 。
。
实验步骤:准确称取 样品,用容量瓶配制成
样品,用容量瓶配制成 溶液;取
溶液;取 上述溶液于碘量瓶中,加入适量稀硫酸和过量
上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,充分反应后,用
溶液,充分反应后,用 标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗 溶液平均为
溶液平均为 。
。
(1)滴定终点的颜色变化为_______ 。
(2)该样品的有效氯含量表达式为_______ (化为最简式)。(该样品的有效氯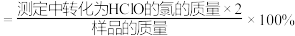 )
)
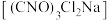 是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的
是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的 溶液和
溶液和 固体,在
固体,在 时反应制备二氯异氰尿酸钠。某实验小组通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
时反应制备二氯异氰尿酸钠。某实验小组通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。反应原理:
 ,
, ,
, 。
。实验步骤:准确称取
 样品,用容量瓶配制成
样品,用容量瓶配制成 溶液;取
溶液;取 上述溶液于碘量瓶中,加入适量稀硫酸和过量
上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,充分反应后,用
溶液,充分反应后,用 标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗 溶液平均为
溶液平均为 。
。(1)滴定终点的颜色变化为
(2)该样品的有效氯含量表达式为
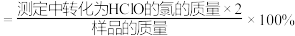 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
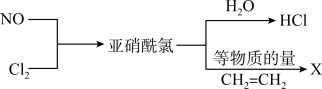
【推荐1】亚硝酰氯(NOCl)是有机药物制备的重要试剂,可按以下流程合成和利用。
请回答:
(1)NOCl的电子式为_______ ,化合物X的结构简式为_______ 。
(2)下列说法正确的是_______。
(3)已知浓盐酸和浓硝酸混合配制王水时也会产生亚硝酰氯,写出该反应的化学方程式_______ 。
(4)设计实验验证化合物X中含有Cl元素_______ ;写出实验过程中涉及的反应方程式_______ 。
请回答:
(1)NOCl的电子式为
(2)下列说法正确的是_______。
| A.NOCl中的氮元素呈正价 |
| B.NOCl分子的空间结构为V形 |
C.化合物X的沸点低于氯乙酰胺( ) ) |
| D.工业上可以用蒸馏水吸收多余的NOCl,防止污染环境 |
(3)已知浓盐酸和浓硝酸混合配制王水时也会产生亚硝酰氯,写出该反应的化学方程式
(4)设计实验验证化合物X中含有Cl元素
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】
(1)沧州铁狮酒的主要成分是我们学习的有机物—乙醇,请写出乙醇分子的官能团的名称______ ,该官能团的电子式______ 。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物。
①能氧化成醛的是____________________ (填字母,下同);
②不能发生消去反应形成烯的是_________ ;
③能氧化成酮的是_____ 。
(2)下列实验不能达到预期目的的是__________
A.实验室用无水乙醇加热至170℃,可制得乙烯
B.只用新制氢氧化铜悬浊液可将乙醇、乙醛、乙酸三种液体区别出来
C.在混有杂质苯酚的苯中,加入适量溴水,过滤后得到纯净的苯
D.在10%的NaOH溶液中滴入2%的CuSO4溶液至过量,再加入乙醛溶液加热至沸腾,溶液中有红色沉淀产生
E.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
F.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在
(1)沧州铁狮酒的主要成分是我们学习的有机物—乙醇,请写出乙醇分子的官能团的名称
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物。
①能氧化成醛的是
②不能发生消去反应形成烯的是
③能氧化成酮的是
(2)下列实验不能达到预期目的的是
A.实验室用无水乙醇加热至170℃,可制得乙烯
B.只用新制氢氧化铜悬浊液可将乙醇、乙醛、乙酸三种液体区别出来
C.在混有杂质苯酚的苯中,加入适量溴水,过滤后得到纯净的苯
D.在10%的NaOH溶液中滴入2%的CuSO4溶液至过量,再加入乙醛溶液加热至沸腾,溶液中有红色沉淀产生
E.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
F.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】已知下面两个反应,其中A为氯代烃,B为烯烃(其相对分子质量为42)
反应①:A B
B
反应②:CH3CH2CH=CH2+HBr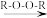 CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
请回答下列问题:
(1)化合物B的分子式为________ 。
(2)假设A在核磁共振氢谱中具有两组峰且峰面积之比为6∶1,则反应①的化学方程式为________ ,反应类型为________ ;A在KOH水溶液中加热反应,生成的有机化合物的结构简式为______ 。
(3)写出B在有机过氧化物(R—O—O—R)中与HBr反应的化学方程式__________ 。
(4)下列有关实验室检验A中是否有氯元素的方法或试剂正确的是________ (填字母)。
a 燃烧法 b AgNO3溶液
c NaOH溶液+稀硝酸+AgNO3溶液 d NaOH醇溶液+AgNO3溶液
(5)B是一种无色气体,如何检验反应①中B的生成__________ 。
反应①:A
 B
B反应②:CH3CH2CH=CH2+HBr
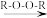 CH3CH2CH2CH2Br
CH3CH2CH2CH2Br请回答下列问题:
(1)化合物B的分子式为
(2)假设A在核磁共振氢谱中具有两组峰且峰面积之比为6∶1,则反应①的化学方程式为
(3)写出B在有机过氧化物(R—O—O—R)中与HBr反应的化学方程式
(4)下列有关实验室检验A中是否有氯元素的方法或试剂正确的是
a 燃烧法 b AgNO3溶液
c NaOH溶液+稀硝酸+AgNO3溶液 d NaOH醇溶液+AgNO3溶液
(5)B是一种无色气体,如何检验反应①中B的生成
您最近一年使用:0次

 稀硫酸中,然后滴加
稀硫酸中,然后滴加 的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。
的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。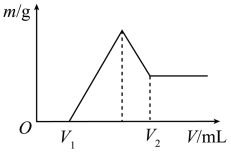
 、
、 刚好沉淀完全,则滴入NaOH溶液的体积
刚好沉淀完全,则滴入NaOH溶液的体积
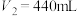 时,金属粉末中
时,金属粉末中