要使0.1mol/L氨水溶液中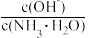 值增大,可以采取的措施是
值增大,可以采取的措施是
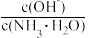 值增大,可以采取的措施是
值增大,可以采取的措施是| A.加少量盐酸溶液 | B.加入少量NH4Cl晶体 |
| C.加少量NH3 | D.加水 |
更新时间:2021-01-07 20:41:51
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
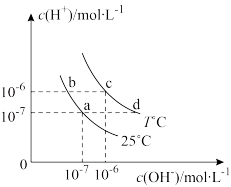

| A.向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) |
| B.25℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 |
| C.T℃时,0.1mol/L的NaOH溶液pH=11 |
D.b点对应的溶液中大量存在:K+、Fe2+、 、I- 、I- |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向100mL0.lmol/LNH4Cl溶液中,逐滴滴加0.1mol/LNaOH溶液。NH4+和NH3∙H2O的变化趋势如图所示(不考虑生成NH3,已知NH3∙H2O的kb=1.8 10-5),下列说法正确的是( )
10-5),下列说法正确的是( )
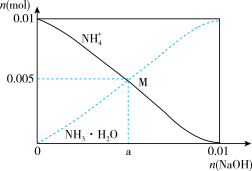
 10-5),下列说法正确的是( )
10-5),下列说法正确的是( )
| A.a=0.005 |
| B.在M点时,n(H+)—n(OH—)=(0.005—a)mol |
C.随着NaOH溶液的滴加, 不断增大 不断增大 |
D.当n((NaOH)) =0.01 mol 时,c ((NH3•H2O) c (Na+) c (Na+) c (OH-) c (OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】pH均为11的火碱溶液和氨水各1升,分别加水稀释到pH均10, 所加水的量
| A.前者多 | B.后者多 | C.相等 | D.无法确定 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列关于常温下的电解质溶液的说法正确的是
A.35℃时,纯水中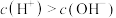 |
B.向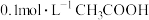 溶液加水稀释时会引起溶液中 溶液加水稀释时会引起溶液中 减小 减小 |
| C.电离平衡右移,弱电解质的电离程度一定增大 |
| D.除了水的电离平衡外,盐酸中不存在其他电离平衡 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】将10ml 0.1mol/L的HAc加水稀释,有关稀释后的醋酸溶液的说法,错误的是
| A.电离程度增大 | B.溶液中离子总数增多 |
| C.溶液导电性减弱 | D.溶液中醋酸分子增多 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】醋酸溶液中存在电离平衡:CH3COOH  H++CH3COO-,△H>0。已知25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5。下列叙述不正确的是
H++CH3COO-,△H>0。已知25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5。下列叙述不正确的是
 H++CH3COO-,△H>0。已知25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5。下列叙述不正确的是
H++CH3COO-,△H>0。已知25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5。下列叙述不正确的是| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,平衡时溶液中c(H+)减小 |
| B.向该溶液中加少量CH3COONa固体,平衡逆向移动 |
| C.该温度下,0.01 mol·L-1醋酸溶液的Ka = 1.75×10-5 |
| D.升高温度,c(H+)增大,Ka增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温下,向CH3COOH溶液中加少量CH3COONa固体,溶液中减小的是
| A.c(H+) | B.c(OH-) | C.c(CH3COO-) | D.c(CH3COOH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】向0.1 mol·L-1 CH3COOH溶液中加入少量的CH3COONa晶体时,会引起
| A.溶液中的c(H+)减小 | B.溶液中的c(H+)增大 |
| C.溶液的导电能力减弱 | D.溶液中的c(OH-)减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知0.1 mol·L-1的氢氟酸溶液中存在电离平衡:HF F-+H+,要使溶液中
F-+H+,要使溶液中 的值增大,可以采取的措施是( )
的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③通入少量HF气体 ④加水
 F-+H+,要使溶液中
F-+H+,要使溶液中 的值增大,可以采取的措施是( )
的值增大,可以采取的措施是( )①加少量烧碱溶液 ②升高温度 ③通入少量HF气体 ④加水
| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】向0.1mol·L-1稀盐酸中分别加入下列固体物质,溶液中c(H+)可能不变的是
| A.CH3COONa | B.AgNO3 | C.KOH | D.Zn |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】醋酸的电离方程式为CH3COOH(aq)⇌H+(aq)+CH3COO-(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液Ka=1.75×10-5(Ka表示酸的电离常数)。下列说法正确的是
| A.升高温度,c(H+)增大,Ka变大 |
| B.该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
您最近一年使用:0次

 减小
减小

