高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH、MgO和Fe2O3)可用于制备MnSO4晶体,工艺流程如下:

该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
回答以下问题:
(1) MnSO4中阴离子的空间构型为_______ 。
(2)提高“反应Ⅰ”速率可采取的措施是_______ (除“加热”外,任写一种),滤渣A的主要成分为_______ (填化学式)。
(3) “反应Ⅱ”中硫铁矿(FeS2)的作用为_______ 。
(4)“反应Ⅲ”的离子方程式为_______ 。
(5)“调pH”步骤中,应调节pH不低于_______ 。
(6)取0.1510 g MnSO4固体,溶于适量水中,加硫酸酸化,用过量NaBiO3(难溶于水)将其完全氧化为 ,过滤,洗涤,洗涤液并入滤液后,加入0.5360 g Na2C2O4固体,充分反应后,用0.0320 mol/L KMnO4溶液滴定,用去20.00 mL,计算样品中MnSO4的质量分数
,过滤,洗涤,洗涤液并入滤液后,加入0.5360 g Na2C2O4固体,充分反应后,用0.0320 mol/L KMnO4溶液滴定,用去20.00 mL,计算样品中MnSO4的质量分数_______ (保留三位有效数字)。

该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
(1) MnSO4中阴离子的空间构型为
(2)提高“反应Ⅰ”速率可采取的措施是
(3) “反应Ⅱ”中硫铁矿(FeS2)的作用为
(4)“反应Ⅲ”的离子方程式为
(5)“调pH”步骤中,应调节pH不低于
(6)取0.1510 g MnSO4固体,溶于适量水中,加硫酸酸化,用过量NaBiO3(难溶于水)将其完全氧化为
 ,过滤,洗涤,洗涤液并入滤液后,加入0.5360 g Na2C2O4固体,充分反应后,用0.0320 mol/L KMnO4溶液滴定,用去20.00 mL,计算样品中MnSO4的质量分数
,过滤,洗涤,洗涤液并入滤液后,加入0.5360 g Na2C2O4固体,充分反应后,用0.0320 mol/L KMnO4溶液滴定,用去20.00 mL,计算样品中MnSO4的质量分数
2021·辽宁·模拟预测 查看更多[5]
(已下线)章末综合评价(八)(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)培优08 制备类工业流程(提高练)-2021年高考化学大题培优练(新高考地区专用)(已下线)大题01 化学工艺流程题(一)-【考前抓大题】备战2021年高考化学(全国通用)辽宁省2021年普通高中学业水平选择考适应性测试化学试题
更新时间:2021-01-25 13:16:09
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。赤泥含有 、
、 、
、 、
、 等,以赤泥为原料提取氧化钪
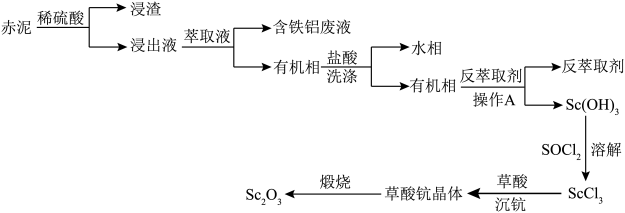
等,以赤泥为原料提取氧化钪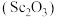 的流程如下:
的流程如下:
已知:① ,
, 易水解;②常温下,“浸出液”中
易水解;②常温下,“浸出液”中 ,
,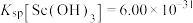 。
。
回答下列问题:
(1)操作A是___________ 。
(2)“溶解”中 作用有将
作用有将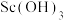 转化成
转化成 、作溶剂和
、作溶剂和___________ 。
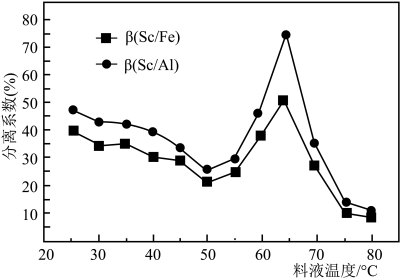
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为___________ 、___________ 。“萃取”过程中应控制pH小于___________ 。
[分离系数指分离后混合体系中某物质的物质的量分数,如 %]
%]
(4)已知 ,
,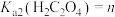 ,
,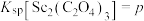 。“沉钪”时,发生反应:
。“沉钪”时,发生反应: ,此反应的平衡常数
,此反应的平衡常数
___________ (用含m、n、p的代数式表示)。
(5)草酸钪晶体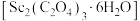 隔绝空气加热,
隔绝空气加热,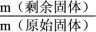 随温度的变化情况如图所示。
随温度的变化情况如图所示。
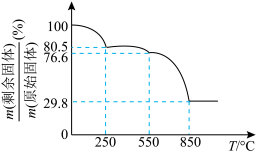
550℃时,晶体的成分是___________ (填化学式),550~850℃,生成气体的物质的量之比为___________ (已知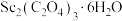 的摩尔质量为
的摩尔质量为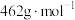 )。
)。
 、
、 、
、 、
、 等,以赤泥为原料提取氧化钪
等,以赤泥为原料提取氧化钪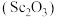 的流程如下:
的流程如下:
已知:①
 ,
, 易水解;②常温下,“浸出液”中
易水解;②常温下,“浸出液”中 ,
,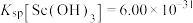 。
。回答下列问题:
(1)操作A是
(2)“溶解”中
 作用有将
作用有将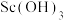 转化成
转化成 、作溶剂和
、作溶剂和(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为
[分离系数指分离后混合体系中某物质的物质的量分数,如
 %]
%]
| w(P507) | 分相情况 | 钪萃取率(%) | 铁萃取率(%) |
| 1% | 分相容易 | 90.74 | 14.89 |
| 2% | 分相容易 | 91.74 | 19.88 |
| 3% | 分相容易 | 92.14 | 13.30 |
| 5% | 有第三相 | 90.59 | 28.47 |
| 8% | 轻微乳化 | 90.59 | 34.85 |
 ,
,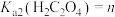 ,
,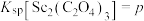 。“沉钪”时,发生反应:
。“沉钪”时,发生反应: ,此反应的平衡常数
,此反应的平衡常数
(5)草酸钪晶体
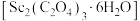 隔绝空气加热,
隔绝空气加热,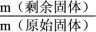 随温度的变化情况如图所示。
随温度的变化情况如图所示。
550℃时,晶体的成分是
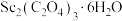 的摩尔质量为
的摩尔质量为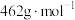 )。
)。
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】铜转炉烟灰的主要成分为含金属元素(主要为 、
、 、
、 、
、 )的硫酸盐和氧化物以及
)的硫酸盐和氧化物以及 ,其有价金属回收工艺流程如下。已知:
,其有价金属回收工艺流程如下。已知: 时,
时, ,
, 。回答下列问题:
。回答下列问题:

(1) 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。 的空间结构为
的空间结构为_______ 。
(2)“浸出液①”中所含有的金属阳离子有_______ 和 、
、 。“浸出”中,当硫酸浓度大于
。“浸出”中,当硫酸浓度大于 时,金属离子浸出率反而下降,原因是
时,金属离子浸出率反而下降,原因是_______ 。
(3)“除杂”中,加入 调
调 至5.2,用
至5.2,用 溶液氧化后,所得“滤渣”主要成分为
溶液氧化后,所得“滤渣”主要成分为 、
、 ,该氧化过程的离子方程式为
,该氧化过程的离子方程式为_______ 。
(4)“转化”后,“滤饼”的主要成分是 和
和_______ 。该工艺中,可循环利用的物质有_______ 。
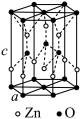
(5) 的一种晶体结构如图所示。由图可知,
的一种晶体结构如图所示。由图可知, 原子位于O原子所围成的
原子位于O原子所围成的_______ 空隙中(填“四面体”或“八面体”),已知晶胞参数为 、
、 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞密度为
,则晶胞密度为_______  。(列出计算式)
。(列出计算式)
 、
、 、
、 、
、 )的硫酸盐和氧化物以及
)的硫酸盐和氧化物以及 ,其有价金属回收工艺流程如下。已知:
,其有价金属回收工艺流程如下。已知: 时,
时, ,
, 。回答下列问题:
。回答下列问题:
(1)
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为 的空间结构为
的空间结构为(2)“浸出液①”中所含有的金属阳离子有
 、
、 。“浸出”中,当硫酸浓度大于
。“浸出”中,当硫酸浓度大于 时,金属离子浸出率反而下降,原因是
时,金属离子浸出率反而下降,原因是(3)“除杂”中,加入
 调
调 至5.2,用
至5.2,用 溶液氧化后,所得“滤渣”主要成分为
溶液氧化后,所得“滤渣”主要成分为 、
、 ,该氧化过程的离子方程式为
,该氧化过程的离子方程式为(4)“转化”后,“滤饼”的主要成分是
 和
和(5)
 的一种晶体结构如图所示。由图可知,
的一种晶体结构如图所示。由图可知, 原子位于O原子所围成的
原子位于O原子所围成的 、
、 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞密度为
,则晶胞密度为 。(列出计算式)
。(列出计算式)
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
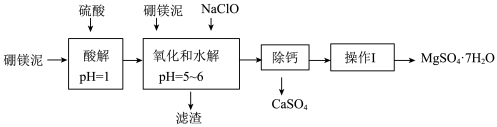
已知:某些氢氧化物沉淀的pH如下表所示:
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:________________ .
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O═MnO2↓+2H++Cl﹣,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为_________________ .
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3、MnO2外,还有______________________ .
(4)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,____________ .“操作I”是将滤液继续蒸发浓缩,冷却结晶,__________ ,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为_______ .(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注___________ .


已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
 | 9.3 | 10.8 |
 | 7.6 | 9.6 |
 | 2.7 | 3.7 |
 | 3.7 | 4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O═MnO2↓+2H++Cl﹣,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3、MnO2外,还有
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
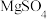 | 30.9 | 33.4 | 35.6 | 36.9 |
 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注

您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】氮化镓( GaN)具有优异的光电性能。一种炼锌矿渣,主要含铁酸镓[ Ga2(Fe2O4)3]、铁酸锌( ZnFe2O4)和SiO2,利用该矿渣制备GaN的工艺流程如下:
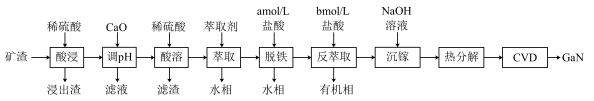
已知:①Ga与Al同主族,化学性质相似。
②常温下,Ksp[Zn(OH)2]=10-16.6,Ksp[Ga(OH)3] =10-35.1,Ksp[Fe(OH)3] =10-38.5。
③Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:.
(1)①“酸浸”时Ga2(Fe2O4)3发生反应的离子方程式为_________________ 。
②“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21g·L-1、65g· L-1,常温下,为尽可能多地提取Ga3+并确保不混入Zn( OH)2,“调pH”时应不超过_____________ (忽略溶液体积变化)。
(2)滤渣2的主要成分是____ (填化学式)。
(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=________ ,b=_______ (选填上表中盐酸的浓度)。
(4)“沉镓”时,若加入NaOH的量过多,会导致____________ 。
(5)利用CVD(化学气相沉积)技术,将热分解产物与NH3在高温下反应可制得GaN,该反应的化学方程式为_______________ 。
(6)①GaN的熔点为1700°C,GaCl3的熔点为77. 9°C,它们的晶体类型依次为___________ 、__________ 。
②GaN晶体的一种立方晶胞如图所示,该晶体中与Ga原子距离最近且相等的N原子个数为________ ,该晶体密度为 ρg·cm-3,则晶胞边长为______ nm( 列出计算式,NA为阿伏加德罗常数的值)。


已知:①Ga与Al同主族,化学性质相似。
②常温下,Ksp[Zn(OH)2]=10-16.6,Ksp[Ga(OH)3] =10-35.1,Ksp[Fe(OH)3] =10-38.5。
③Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
盐酸浓度/mol·L-1 | 反萃取率/% | |
Ga3+ | Fe3+ | |
2 | 86.9 | 9.4 |
4 | 69.1 | 52.1 |
6 | 17.5 | 71.3 |
(1)①“酸浸”时Ga2(Fe2O4)3发生反应的离子方程式为
②“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21g·L-1、65g· L-1,常温下,为尽可能多地提取Ga3+并确保不混入Zn( OH)2,“调pH”时应不超过
(2)滤渣2的主要成分是
(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=
(4)“沉镓”时,若加入NaOH的量过多,会导致
(5)利用CVD(化学气相沉积)技术,将热分解产物与NH3在高温下反应可制得GaN,该反应的化学方程式为
(6)①GaN的熔点为1700°C,GaCl3的熔点为77. 9°C,它们的晶体类型依次为
②GaN晶体的一种立方晶胞如图所示,该晶体中与Ga原子距离最近且相等的N原子个数为

您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】三氯化铬( )可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用
)可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用 和
和 制备无水
制备无水 并测定产品纯度,进行如图实验探究,回答下列问题:
并测定产品纯度,进行如图实验探究,回答下列问题:
(1)制备无水
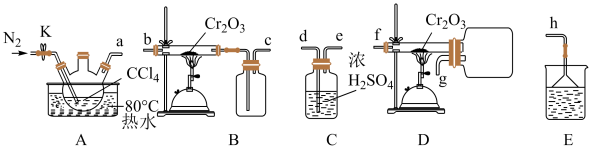
①所选装置的连接顺序为:A→___________ →C→E(填“B”或“D”),不选另一装置的原因是:___________ 。
②实验开始时,点燃酒精喷灯适合在水浴加热之___________ (填“前”或“后”)。
③已知制备 时有
时有 气体生成,制备
气体生成,制备 反应的化学方程式为
反应的化学方程式为___________ ;
 气体易水解则尾气处理时适合选用的试剂为
气体易水解则尾气处理时适合选用的试剂为___________ (填序号)。
A. 溶液 B.稀
溶液 B.稀 溶液 C.水
溶液 C.水
(2)测定产品纯度(杂质不参加反应)
已知:
准确称取31.7g产品,温水溶解后稀释至250 ,量取25.00
,量取25.00 溶液加入锥形瓶中,向其中加入足量
溶液加入锥形瓶中,向其中加入足量 充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量
充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量 溶液;滴加淀粉作指示剂,用2
溶液;滴加淀粉作指示剂,用2
 标准溶液滴定
标准溶液滴定 ,达到滴定终点时消耗标准液的体积为15
,达到滴定终点时消耗标准液的体积为15 。
。
①加入足量 的主要作用为
的主要作用为___________ 。
②写出加硫酸酸化后的橙色物质与 溶液发生反应的离子方程式
溶液发生反应的离子方程式___________ 。
③反应后溶液煮沸的目的为___________ 。
④产品中 的质量分数为
的质量分数为___________ 。
 )可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用
)可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用 和
和 制备无水
制备无水 并测定产品纯度,进行如图实验探究,回答下列问题:
并测定产品纯度,进行如图实验探究,回答下列问题:(1)制备无水


①所选装置的连接顺序为:A→
②实验开始时,点燃酒精喷灯适合在水浴加热之
③已知制备
 时有
时有 气体生成,制备
气体生成,制备 反应的化学方程式为
反应的化学方程式为 气体易水解则尾气处理时适合选用的试剂为
气体易水解则尾气处理时适合选用的试剂为A.
 溶液 B.稀
溶液 B.稀 溶液 C.水
溶液 C.水(2)测定产品纯度(杂质不参加反应)
已知:

准确称取31.7g产品,温水溶解后稀释至250
 ,量取25.00
,量取25.00 溶液加入锥形瓶中,向其中加入足量
溶液加入锥形瓶中,向其中加入足量 充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量
充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量 溶液;滴加淀粉作指示剂,用2
溶液;滴加淀粉作指示剂,用2
 标准溶液滴定
标准溶液滴定 ,达到滴定终点时消耗标准液的体积为15
,达到滴定终点时消耗标准液的体积为15 。
。①加入足量
 的主要作用为
的主要作用为②写出加硫酸酸化后的橙色物质与
 溶液发生反应的离子方程式
溶液发生反应的离子方程式③反应后溶液煮沸的目的为
④产品中
 的质量分数为
的质量分数为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:
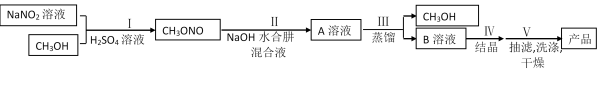
已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________ ;步骤Ⅱ中生成NaN3的化学方程式为______________________ 。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):
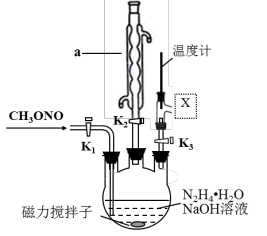
①仪器a的名称为____________ ,作用是_________________ 。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________ 。(合理给分)
③图中X处连接的最合适装置应为下图中的_________ 。
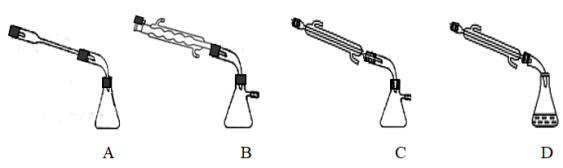
(3)步骤Ⅱ中制备叠氮化钠的操作是_______ ;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________ 。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______ 洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________ 。下列操作合理的是______ 。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
| 熔点℃ | 沸点℃ | 溶解性 | |
| CH3OH | −97 | 64.7 | 与水互溶 |
| 水合肼 (N2H4•H2O) | −51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
| 亚硝酸甲酯(CH3ONO) | −17 | −12 | 溶于乙醇、乙醚 |
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):

①仪器a的名称为
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是
③图中X处连接的最合适装置应为下图中的

(3)步骤Ⅱ中制备叠氮化钠的操作是
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
您最近半年使用:0次



