水体中的Cr2O 、HCrO
、HCrO 和CrO
和CrO 是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。
是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。
(1)在一定pH的水溶液中,HS-、S2-可与CrO 反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S
反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S ,S
,S 能还原Cr(Ⅵ)。
能还原Cr(Ⅵ)。
①在pH=9的水溶液中CrO 与HS-反应的离子方程式为
与HS-反应的离子方程式为_______ 。
②25℃时用过量S2-还原Cr(Ⅵ),发现反应后期Cr(Ⅵ)被还原的速率反而加快。产生该现象的原因可能是_______ ;验证的实验方法是_______ 。
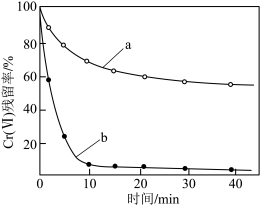
(2)金属也可用于还原废水中的Cr(Ⅵ)。其他条件相同时,用相同物质的量的Zn粉、Zn-Cu粉分别处理pH=2.5的含Cr(Ⅵ)废水,废水中Cr(Ⅵ)残留率随时间的变化如图所示。图中b对应的实验方法处理含Cr(Ⅵ)废水的效果更好,其原因是_______ 。
(3)用氧化铁包裹的纳米铁粉(用Fe@Fe2O3表示)能有效还原水溶液中的Cr(Ⅵ)。Fe@Fe2O3还原近中性废水中Cr(Ⅵ)的可能反应机理如图所示。Fe@Fe2O3中Fe还原CrO 的过程可描述为
的过程可描述为_______ 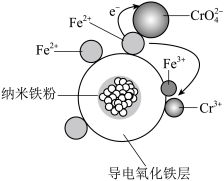 。
。
 、HCrO
、HCrO 和CrO
和CrO 是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。
是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。(1)在一定pH的水溶液中,HS-、S2-可与CrO
 反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S
反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S ,S
,S 能还原Cr(Ⅵ)。
能还原Cr(Ⅵ)。①在pH=9的水溶液中CrO
 与HS-反应的离子方程式为
与HS-反应的离子方程式为②25℃时用过量S2-还原Cr(Ⅵ),发现反应后期Cr(Ⅵ)被还原的速率反而加快。产生该现象的原因可能是
(2)金属也可用于还原废水中的Cr(Ⅵ)。其他条件相同时,用相同物质的量的Zn粉、Zn-Cu粉分别处理pH=2.5的含Cr(Ⅵ)废水,废水中Cr(Ⅵ)残留率随时间的变化如图所示。图中b对应的实验方法处理含Cr(Ⅵ)废水的效果更好,其原因是

(3)用氧化铁包裹的纳米铁粉(用Fe@Fe2O3表示)能有效还原水溶液中的Cr(Ⅵ)。Fe@Fe2O3还原近中性废水中Cr(Ⅵ)的可能反应机理如图所示。Fe@Fe2O3中Fe还原CrO
 的过程可描述为
的过程可描述为 。
。
2021·江苏·模拟预测 查看更多[3]
(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练江苏省2021年普通高中学业水平选择考适应性测试化学试题
更新时间:2021-01-25 14:14:40
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______ ,氧化产物与还原产物的物质的量之比为_______ 。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):①___ KMnO4+____ K2S+______ ===___ K2MnO4+___ K2SO4+___ S↓+______ 。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___ 。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):①
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为
您最近半年使用:0次
【推荐2】阅读下面科普信息,回答问题:
一个体重 的健康人含铁2g,这2g铁在人体中以
的健康人含铁2g,这2g铁在人体中以 和
和 的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是_______ (填字母)。
A. B.
B. C.
C.
(2)工业盐的主要成分是 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ 性。
(3)为了防止钢铁零件生锈,常用 进行化学处理方法使钢铁零件表面生成
进行化学处理方法使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为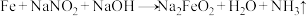 (未配平),上述反应中氧化剂与还原剂的化学计量系数之比为
(未配平),上述反应中氧化剂与还原剂的化学计量系数之比为_______ 。
(4)某同学把氯气通入 溶液中,生成
溶液中,生成 和
和 ,请写出该反应的化学方程式:
,请写出该反应的化学方程式:_______ 。
(5)工业废水中的 可用铝粉除去。已知此反应体系中包含
可用铝粉除去。已知此反应体系中包含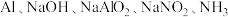 和
和 六种物质,该反应的化学方程式为
六种物质,该反应的化学方程式为_______ 。
一个体重
 的健康人含铁2g,这2g铁在人体中以
的健康人含铁2g,这2g铁在人体中以 和
和 的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是
A.
 B.
B. C.
C.
(2)工业盐的主要成分是
 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(3)为了防止钢铁零件生锈,常用
 进行化学处理方法使钢铁零件表面生成
进行化学处理方法使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为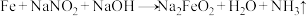 (未配平),上述反应中氧化剂与还原剂的化学计量系数之比为
(未配平),上述反应中氧化剂与还原剂的化学计量系数之比为(4)某同学把氯气通入
 溶液中,生成
溶液中,生成 和
和 ,请写出该反应的化学方程式:
,请写出该反应的化学方程式:(5)工业废水中的
 可用铝粉除去。已知此反应体系中包含
可用铝粉除去。已知此反应体系中包含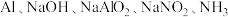 和
和 六种物质,该反应的化学方程式为
六种物质,该反应的化学方程式为
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】(1)已知用金属钠制取氧化钠,可有多种方法:
①4Na+O2===2Na2O
②4Na+CO2===2Na2O+C
③2NaNO2+6Na===4Na2O+N2↑
在上述三种方法中最好的是_______ ,原因是______________________________________ 。该反应中作氧化剂的是________ 。
(2)据资料介绍:过氧化钠是钠在空气中燃烧的主要产物,由于空气中还含有其他成分,因此还存在其他产物,如氮化钠。已知氮化钠与水反应能生成氢氧化钠和氨气,则氮化钠与水反应的化学方程式为____________________________ 。
①4Na+O2===2Na2O
②4Na+CO2===2Na2O+C
③2NaNO2+6Na===4Na2O+N2↑
在上述三种方法中最好的是
(2)据资料介绍:过氧化钠是钠在空气中燃烧的主要产物,由于空气中还含有其他成分,因此还存在其他产物,如氮化钠。已知氮化钠与水反应能生成氢氧化钠和氨气,则氮化钠与水反应的化学方程式为
您最近半年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是_________ ;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2—放电产生气体的电极反应式______________ 。
(2)利用化学反应也能制取氟。请配平下列化学方程式:
____ K2MnF6+____ SbF5—____ KSbF6+____ MnF3+____ F2↑;其中还原产物是________ 。
(3)某温度下测得浓度均为0.10mol/L的KF和HF混合液的pH=4,近似计算HF的电离平衡常数Ka(写出计算过程)_________ 。
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随PH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:__________ 。
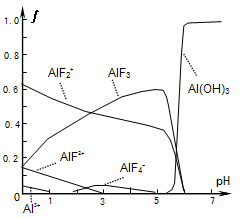
(1)不能通过电解纯净的液态HF获得F2,其原因是
(2)利用化学反应也能制取氟。请配平下列化学方程式:
(3)某温度下测得浓度均为0.10mol/L的KF和HF混合液的pH=4,近似计算HF的电离平衡常数Ka(写出计算过程)
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随PH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:

您最近半年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为AI级高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,该反应体系中的物质有NaCl 、H2O、ClO2、NaClO3、Cl2、HCl。
(1)写出并配平该反应的化学方程式_____________________________________ 。
(2)该反应的还原产物是_____________ 。
(3)在标准状况下,如果反应中生成11.2L氯气,则被氧化的HCl的物质的量为______ ,转移电子数目为 ___________ 。
(4)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2通入到含有H2S(二元弱酸)的水中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式_________________________________ 。
(1)写出并配平该反应的化学方程式
(2)该反应的还原产物是
(3)在标准状况下,如果反应中生成11.2L氯气,则被氧化的HCl的物质的量为
(4)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2通入到含有H2S(二元弱酸)的水中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式
您最近半年使用:0次
【推荐3】回答下列问题:
(1)某反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,试回答下列问题。
①在上述5种物质中,_____ 是反应物,_____ 是生成物。
②在上述反应中,表现出氧化性的物质是____ ,_____ 是还原产物。
③写出该反应的化学方程式:_____ 。
(2)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
①氧化剂是_____ ,还原剂是_____ 。
②氧化剂与还原剂的质量之比为_____ 。
③当生成28gN2时,被氧化的物质为____ g。
(1)某反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,试回答下列问题。
①在上述5种物质中,
②在上述反应中,表现出氧化性的物质是
③写出该反应的化学方程式:
(2)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
①氧化剂是
②氧化剂与还原剂的质量之比为
③当生成28gN2时,被氧化的物质为
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)已知下列热化学方程式

 ①
①

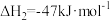 ②
②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g) ③
③
写出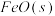 被CO还原成Fe和
被CO还原成Fe和 的热化学方程式
的热化学方程式________ 。
(2)直接氨硼烷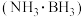 电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为
电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为 。已知两极室中电解质足量,则正极的电极反应为
。已知两极室中电解质足量,则正极的电极反应为________________ ,当电路中转移0.6mol电子时,左右两极室的质量差为________ 。

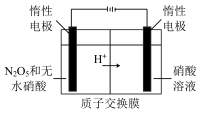
(3) 是绿色硝化试剂,溶于水可得硝酸,下图是以N2O4为原料电解制备N2O5的装置,写出阳极区生成N2O5的电极反应为
是绿色硝化试剂,溶于水可得硝酸,下图是以N2O4为原料电解制备N2O5的装置,写出阳极区生成N2O5的电极反应为______________________ 。
(4)1.52g铜镁合金完全溶解于50mL密度为 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体1120mL(标准状况),向反应后的溶液中加入
的混合气体1120mL(标准状况),向反应后的溶液中加入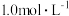 NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,加入的NaOH溶液体积
NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,加入的NaOH溶液体积________ 。

 ①
①
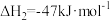 ②
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
 ③
③写出
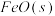 被CO还原成Fe和
被CO还原成Fe和 的热化学方程式
的热化学方程式(2)直接氨硼烷
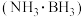 电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为
电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为 。已知两极室中电解质足量,则正极的电极反应为
。已知两极室中电解质足量,则正极的电极反应为
(3)
 是绿色硝化试剂,溶于水可得硝酸,下图是以N2O4为原料电解制备N2O5的装置,写出阳极区生成N2O5的电极反应为
是绿色硝化试剂,溶于水可得硝酸,下图是以N2O4为原料电解制备N2O5的装置,写出阳极区生成N2O5的电极反应为
(4)1.52g铜镁合金完全溶解于50mL密度为
 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体1120mL(标准状况),向反应后的溶液中加入
的混合气体1120mL(标准状况),向反应后的溶液中加入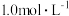 NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,加入的NaOH溶液体积
NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,加入的NaOH溶液体积
您最近半年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】1887年,英国人赫勒森发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种。应用广泛的是Zn—MnO2干电池,其电解质溶液是ZnCl2—NH4Cl混合溶液。电池工作一段时间后,电池内存在7种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O。请回答下列问题
(1)该电池的负极材料是__ ;电池工作时,电子流向__ (填“正极”或“负极”,下同);放电时NH4+向___ 移动。
(2)该氧化还原反应的化学方程式为__ ,发生还原反应的物质是__ ,被氧化的元素是__ 。若有17.4g氧化剂参与反应,则电子转移数目为__ NA(NA表示阿伏加 德罗常数的值)。
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是___ 。
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__ 。欲除去Cu2+,最好选用下列试剂中的__ (填序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(1)该电池的负极材料是
(2)该氧化还原反应的化学方程式为
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
a.NaOH b.Zn c.Fe d.NH3·H2O
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】按要求回答下列问题:
(1)煤燃烧排放的烟气含有 和
和 ,形成酸雨,污染大气,采用
,形成酸雨,污染大气,采用 碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有
碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 和NO的烟气,写出
和NO的烟气,写出 溶液脱硝(主要转化为
溶液脱硝(主要转化为 )过程中主要反应的离子方程式:
)过程中主要反应的离子方程式:___________ 。
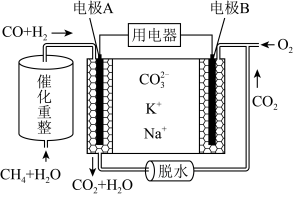
(2)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从电极___________ (“填A或B”)流向用电器。内电路中, 向电极
向电极___________ (“填A或B”)移动,电极A上CO参与的电极反应为___________ 。
(3)某烃的结构简式为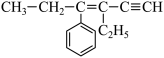 ,该分子中可能共面的碳原子数最多有
,该分子中可能共面的碳原子数最多有___________ 个,一定在同一个平面上的原子至少有___________ 个。
(4)常温下,某气态烃与氧气混合装入密闭容器中,点燃爆炸后回到原温度,此时容器内气体的压强为反应前的一半,经氢氧化钠溶液吸收后,容器内几乎成真空,此烃可能是___________ (写出结构简式)。
(1)煤燃烧排放的烟气含有
 和
和 ,形成酸雨,污染大气,采用
,形成酸雨,污染大气,采用 碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有
碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 和NO的烟气,写出
和NO的烟气,写出 溶液脱硝(主要转化为
溶液脱硝(主要转化为 )过程中主要反应的离子方程式:
)过程中主要反应的离子方程式:(2)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从电极
 向电极
向电极
(3)某烃的结构简式为
 ,该分子中可能共面的碳原子数最多有
,该分子中可能共面的碳原子数最多有(4)常温下,某气态烃与氧气混合装入密闭容器中,点燃爆炸后回到原温度,此时容器内气体的压强为反应前的一半,经氢氧化钠溶液吸收后,容器内几乎成真空,此烃可能是
您最近半年使用:0次



