16. 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH
3)
4]Cl
2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO
2少量Fe
2O
3)为原料均能制备CuSO
4·5H
2O晶体。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO
4·5H
2O晶体。
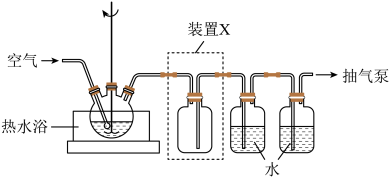
①写出用蚀刻废液制备CuO反应的化学方程式:
_______。
②检验CuO固体是否洗净的实验操作是
_______。
③装置图中装置X的作用是
_______。
(2)以焙烧过的铜精炼炉渣为原料制备CuSO
4·5H
2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,
_______,加热浓缩、冷却结晶、过滤、晾干,得到CuSO
4·5H
2O晶体。已知:①该实验中pH=3.2时,Fe
3+完全沉淀;pH=4.7时,Cu
2+开始沉淀。②实验中可选用的试剂:1.0 mol/L H
2SO
4、1.0 mol/L HCl、1.0 mol/L NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO
4·5H
2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H
2SO
4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na
2S
2O
3标准溶液滴定至终点,消耗Na
2S
2O
3的溶液19.48mL。测定过程中发生下列反应:2Cu
2++4I
-=2CuI↓+I
2、2S
2O

+I
2= S
4O

+2I
-。计算CuSO
4·5H
2O样品的纯度:
_______。