铜在自然界中多以硫化物存在,氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以黄铜矿(主要成分为CuFeS2)为原料制取Cu2O的一种工艺流程如图:

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
(1)把矿石粉碎的目的是_______ ;为了减少炉气污染,可用炉气生产_______ (写化学式),再用于上述工艺。
(2)试剂a可选_______ (填序号);“调pH”应调控的pH范围为_______ 。
A.Cu B.CuO C.CuCO3 D.Cu(OH)2 E.Cu2 (OH)2CO3
(3)“焙烧”后,若Cu、Fe分别呈+2价+3价,写出CuFeS2与O2反应的化学方程式_______ 。
(4)“还原(90℃)”过程发生反应的离子方程式为_______ ;“操作A”包括_______ 、洗涤、隔绝空气烘干。
(5)若用10.00吨含30.00% CuFeS2的矿石生产,假设其它杂质不含铜元素,最后得到Cu2O 0.9504吨,则其产率为_______ (保留四位有效数字)。

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
| Fe2+ | Fe3+ | Cu 2+ | |
| 开始沉淀 | 7.5 | 2.6 | 4.8 |
| 完全沉淀 | 9.5 | 3.3 | 6.4 |
(2)试剂a可选
A.Cu B.CuO C.CuCO3 D.Cu(OH)2 E.Cu2 (OH)2CO3
(3)“焙烧”后,若Cu、Fe分别呈+2价+3价,写出CuFeS2与O2反应的化学方程式
(4)“还原(90℃)”过程发生反应的离子方程式为
(5)若用10.00吨含30.00% CuFeS2的矿石生产,假设其它杂质不含铜元素,最后得到Cu2O 0.9504吨,则其产率为
2021·湖南怀化·一模 查看更多[2]
更新时间:2021-04-06 12:06:40
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】某化学工程师以电子产品废料(含 、
、 、
、 、
、 )为原料,设计回收
)为原料,设计回收 的工艺流程如下:
的工艺流程如下:
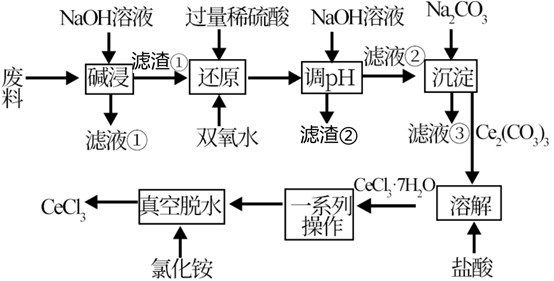
已知:溶液中只有 、
、 能稳定存在。
能稳定存在。
(1)“碱浸”前,将“废料”磨成粉末的目的是_______ 。
(2)“滤液①”中的溶质除过量的 外主要成分为
外主要成分为_______ (填化学式下同),“滤渣②”的主要成分为_______ 。
(3)“还原”工艺中发生氧化还原反应的离子方程式为_______ 。
(4)室温下,已知: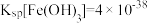 ,
,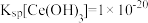 。“还原”后加入稀硫酸调节溶液的
。“还原”后加入稀硫酸调节溶液的 ,当溶液的
,当溶液的 时,
时,
_______ (填“已”或“没有”)除干净(当溶液中某离子浓度小于 时,认为已除干净),若“滤液②”的体积为1L,“废料”中含
时,认为已除干净),若“滤液②”的体积为1L,“废料”中含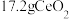 ,不考虑损耗,则“滤液②”中
,不考虑损耗,则“滤液②”中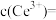
_______ 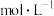 。
。
(5)“一系列操作”包括_______ 、洗涤。
(6)将 、
、 按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为
按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为_______ ;该方法的缺点是_______ 。
 、
、 、
、 、
、 )为原料,设计回收
)为原料,设计回收 的工艺流程如下:
的工艺流程如下:
已知:溶液中只有
 、
、 能稳定存在。
能稳定存在。(1)“碱浸”前,将“废料”磨成粉末的目的是
(2)“滤液①”中的溶质除过量的
 外主要成分为
外主要成分为(3)“还原”工艺中发生氧化还原反应的离子方程式为
(4)室温下,已知:
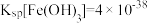 ,
,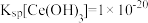 。“还原”后加入稀硫酸调节溶液的
。“还原”后加入稀硫酸调节溶液的 ,当溶液的
,当溶液的 时,
时,
 时,认为已除干净),若“滤液②”的体积为1L,“废料”中含
时,认为已除干净),若“滤液②”的体积为1L,“废料”中含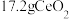 ,不考虑损耗,则“滤液②”中
,不考虑损耗,则“滤液②”中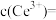
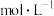 。
。(5)“一系列操作”包括
(6)将
 、
、 按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为
按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂LiTi5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++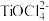 +2H2O
+2H2O
(1)化合物FeTiO3中铁元素的化合价是____________ 。
(2)滤渣A的成分是_________ 。滤渣A的熔点大于干冰的原因是___________ 。
(3)滤液B中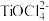 转化生成TiO2的离子方程式是
转化生成TiO2的离子方程式是____________________ 。
(4)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_________ 。
(5)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 LiTi5O12+3FePO4。该电池充电时阳极反应
LiTi5O12+3FePO4。该电池充电时阳极反应______________ .

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++
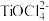 +2H2O
+2H2O(1)化合物FeTiO3中铁元素的化合价是
(2)滤渣A的成分是
(3)滤液B中
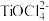 转化生成TiO2的离子方程式是
转化生成TiO2的离子方程式是(4)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是
(5)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4
 LiTi5O12+3FePO4。该电池充电时阳极反应
LiTi5O12+3FePO4。该电池充电时阳极反应
您最近一年使用:0次
【推荐3】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
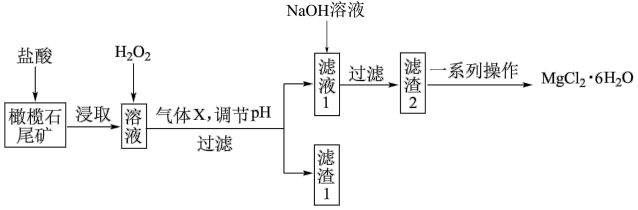
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________ 、__________ (任写两种)。
(2)气体X的电子式为________ ,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________ 。
(3)加入H2O2的目的是______________________ ;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________ 。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________ 、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________ (结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________ (填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有
(2)气体X的电子式为
(3)加入H2O2的目的是
(4)“一系列操作”主要包括加入足量盐酸,然后经过
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为
②下列滴定操作会导致测量结果偏高的是
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为________ (填序号)。
a.氨水 b.氢氧化钠溶液
c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1 000 ℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+1价的Cu比+2价Cu更________ (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为_________________________________________________________________________________ ,
由此可知,在酸性溶液中,+1价Cu比+2价Cu更________ (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为
a→________ →________ →________ →________ →________ →________ →h。

①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是___________________________________________________________________________ 。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生反应的化学方程式为_______________________________ 。
③装置C中的球形装置的作用是_______________________________________________________ 。
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为
a.氨水 b.氢氧化钠溶液
c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1 000 ℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+1价的Cu比+2价Cu更
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为
由此可知,在酸性溶液中,+1价Cu比+2价Cu更
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为
a→

①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生反应的化学方程式为
③装置C中的球形装置的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______ .
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是______ .
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______ .简述你的理由______ .
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设______ 成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______ .
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
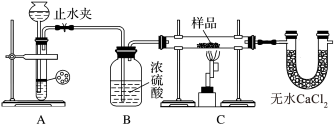
(1)仪器组装完成后,夹好止水夹,______________________ ,则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是______(填选项)
(3)从下列实验步骤中,选择正确的操作顺序:①____________ ③(填序号)。
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________ (用离子方程式表示);丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________ ,其反应的离子方程式为_____ ;丁同学设计实验证明另一种物质是否存在,则其设计方案中检验另一种物质所有试剂名称为______________ 。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________ mol。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,
(2)装置A是氢气的发生装置,可以选用的药品是______(填选项)
| A.稀硫酸和锌片 | B.稀硝酸和铁片 |
| C.氢氧化钠溶液和铝片 | D.浓硫酸和镁片 |
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3胶体,写出该反应的离子方程式:____________________________ 。
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________ 。

(3)写出装置A中发生的离子方程式:______________________ 。
(4)三颈烧瓶用冰水浴的原因是_________________ ,A处盛放KC1O3的仪器名称 ___________ 。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________ 。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42-形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加入稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________ 。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3胶体,写出该反应的离子方程式:
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:

(3)写出装置A中发生的离子方程式:
(4)三颈烧瓶用冰水浴的原因是
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42-形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加入稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学实验小组为了验证SO2和C12的漂白性,设计了如图所示的实验装置:
(1)已知制备SO2的原理为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,使用A装置;制备Cl2采用实验室制法,反应方程式为_______________ 。
(2)E装置中盛放浓盐酸的仪器为_________ ,作用为_________ ;
(3)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B、D试管中的现象是_________ 。
(4) 装置C的作用是_________ 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为_________ 。

(1)已知制备SO2的原理为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,使用A装置;制备Cl2采用实验室制法,反应方程式为
(2)E装置中盛放浓盐酸的仪器为
(3)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B、D试管中的现象是
(4) 装置C的作用是
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为
您最近一年使用:0次
【推荐3】 是一种在水处理等方面有广泛应用的高效安全消毒剂。与
是一种在水处理等方面有广泛应用的高效安全消毒剂。与 相比
相比 不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 沸点为11℃,不稳定,工业上常将
沸点为11℃,不稳定,工业上常将 转化为
转化为 产品便于储存和运输,流程如下:
产品便于储存和运输,流程如下:

已知: 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃析出
,高于38℃析出
(1)在吸收器中, 是作
是作___________ (填“氧化剂”或“还原剂”)。
(2)吸收器中的反应一般在冰水浴中进行,其原因除了防止 分解,还可能
分解,还可能___________ 。
(3)操作a:55℃蒸发至有大量晶体析出、___________ 、用介于38℃~60℃的温水洗涤、低于60℃干燥,得到 固体。
固体。
(4)为确定 产品的纯度,进行如下实验:
产品的纯度,进行如下实验:
步骤1:称取5.000g产品,溶于经煮沸冷却后的蒸馏水,配成250.00mL溶液。
步骤2:取出25.00mL配制的溶液于锥形瓶中,加入过量的 溶液和稀
溶液和稀 ,塞上瓶塞,充分反应
,塞上瓶塞,充分反应 。
。
步骤3:向锥形瓶中滴加两滴淀粉溶液,逐滴加入 的
的 溶液至恰好完全反应
溶液至恰好完全反应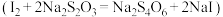 ,共消耗
,共消耗 溶液的体积为20.00mL。
溶液的体积为20.00mL。
①若步骤2中加入的 溶液在空气中放置时间过长,则会导致测得的
溶液在空气中放置时间过长,则会导致测得的 质量分数
质量分数___________ (选填“偏高”、“偏低”或“无影响”)。
②求产品中 的质量分数
的质量分数___________ (产品中的杂质不与 、
、 发生反应,写出计算过程)。
发生反应,写出计算过程)。
 是一种在水处理等方面有广泛应用的高效安全消毒剂。与
是一种在水处理等方面有广泛应用的高效安全消毒剂。与 相比
相比 不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 沸点为11℃,不稳定,工业上常将
沸点为11℃,不稳定,工业上常将 转化为
转化为 产品便于储存和运输,流程如下:
产品便于储存和运输,流程如下:
已知:
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃析出
,高于38℃析出
(1)在吸收器中,
 是作
是作(2)吸收器中的反应一般在冰水浴中进行,其原因除了防止
 分解,还可能
分解,还可能(3)操作a:55℃蒸发至有大量晶体析出、
 固体。
固体。(4)为确定
 产品的纯度,进行如下实验:
产品的纯度,进行如下实验:步骤1:称取5.000g产品,溶于经煮沸冷却后的蒸馏水,配成250.00mL溶液。
步骤2:取出25.00mL配制的溶液于锥形瓶中,加入过量的
 溶液和稀
溶液和稀 ,塞上瓶塞,充分反应
,塞上瓶塞,充分反应 。
。步骤3:向锥形瓶中滴加两滴淀粉溶液,逐滴加入
 的
的 溶液至恰好完全反应
溶液至恰好完全反应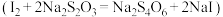 ,共消耗
,共消耗 溶液的体积为20.00mL。
溶液的体积为20.00mL。①若步骤2中加入的
 溶液在空气中放置时间过长,则会导致测得的
溶液在空气中放置时间过长,则会导致测得的 质量分数
质量分数②求产品中
 的质量分数
的质量分数 、
、 发生反应,写出计算过程)。
发生反应,写出计算过程)。
您最近一年使用:0次



