许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)某同学画出基态碳原子的轨道表示式: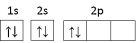 ,该表示式违背了
,该表示式违背了___ ;CH 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 的空间构型为
的空间构型为____ ;CH 中C原子成键的杂化方式为
中C原子成键的杂化方式为_____ 。
(2)34号元素硒的基态原子的价层电子排布式为_______ 。
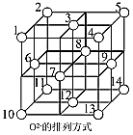
(3)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为_____ ,有_____ %的正八面体空隙没有填充阳离子。
(4)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。
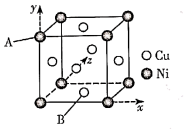
①原子B的坐标参数为____ ;
②若该晶体密度为dg·cm-3,则铜镍原子间最短距离为____ 。
(1)某同学画出基态碳原子的轨道表示式:
 ,该表示式违背了
,该表示式违背了 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 的空间构型为
的空间构型为 中C原子成键的杂化方式为
中C原子成键的杂化方式为(2)34号元素硒的基态原子的价层电子排布式为
(3)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为

(4)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为
②若该晶体密度为dg·cm-3,则铜镍原子间最短距离为
更新时间:2021-04-19 15:50:24
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__ (填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____ 种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________ 。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____ 。1 mol HCHO分子中含有σ键的物质的量为____ mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__ 。与H2O分子互为等电子体的阴离子为__ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______ 。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________ 。
(2)元素B、C、D的第一电离能由小到大排列顺序为________ 。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________ 。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________ 。
(1)下列微粒基态的电子排布中未成对电子数最多的是
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O
 [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN①Zn2+基态核外电子排布式为
②HOCH2CN分子中碳原子轨道的杂化类型是
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为
(2)元素B、C、D的第一电离能由小到大排列顺序为
(3)D元素原子的最外层电子轨道表示式为
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。请回答下列问题:
(1)区分晶体硼和无定形硼最可靠的科学方法为_________________ 。
(2)NaBH4是一种重要的储氢载体,阴离子结构式为______________ 。
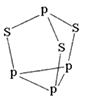
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为________________ (以n表示硼原子的个数)。
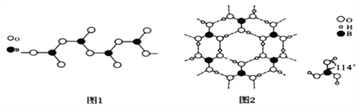
(4)硼酸晶体是片层结构,有与石墨相似的层状结构,图2表示的是其中一层的结构。硼酸晶体中存在的作用力有共价键、________ 、________ 。与H3BO3酸性最接近的是________ (填字母)。
A.H4SiO4B.H3PO4C.HNO2
硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是____________________ 。
(5)三硫化四磷分子(如图)是_________ 分子(填“极性”或非极性),用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________ 。
(1)区分晶体硼和无定形硼最可靠的科学方法为
(2)NaBH4是一种重要的储氢载体,阴离子结构式为
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为

(4)硼酸晶体是片层结构,有与石墨相似的层状结构,图2表示的是其中一层的结构。硼酸晶体中存在的作用力有共价键、
A.H4SiO4B.H3PO4C.HNO2
硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是
(5)三硫化四磷分子(如图)是

您最近一年使用:0次
【推荐3】(1)①LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________ 、中心原子的杂化形式为________ 。LiAlH4中,存在_________ (填标号)。
a.离子键 b. 键 c.
键 c. 键 d.氢键
键 d.氢键
②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
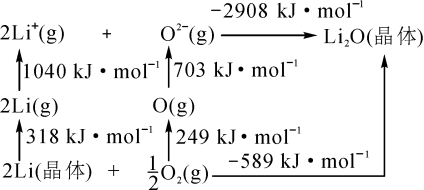
可知,Li原子的第一电离能为_________ kJ·mol-1,O=O键键能为__________ kJ·mol-1,Li2O晶格能为_________ kJ·mol-1
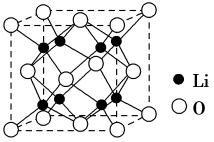
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加 德罗常数的值为NA,则Li2O的密度为___________ g·cm-3(列出计算式)。
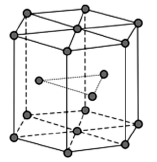
(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______ 。六棱柱底边边长为a cm,高为c cm,阿伏加 德罗常数的值为NA,Zn的密度为______ g·cm-3(列出计算式)。
(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为____________ g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________ nm。
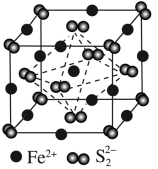
a.离子键 b.
 键 c.
键 c. 键 d.氢键
键 d.氢键②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
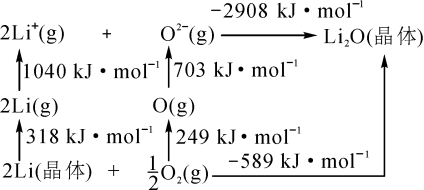
可知,Li原子的第一电离能为
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加 德罗常数的值为NA,则Li2O的密度为

(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为

您最近一年使用:0次
【推荐1】现有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,A原子的最外层电子排布式为1s1。B和D也属同一族,它们原子最外层的p能级与s能级的电子数之比是2∶1,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于s区的是_________ (填元素符号)。
(2)由这五种元素组成的一种化合物是_________________________ (填化学式)。
(3)写出D元素基态原子的最外层电子排布图:____________________ 。
(4)元素电负性:B__________ D,元素第一电离能:C________ E。(填“>”“<”或“=”)
(1)以上这五种元素中,属于s区的是
(2)由这五种元素组成的一种化合物是
(3)写出D元素基态原子的最外层电子排布图:
(4)元素电负性:B
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如下图转化关系,回答下列问题:

(1)若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子,Y原子的电子排布图为_________ ,乙的电子式为________ ;
(2)若X为非金属,甲是由两种短周期元素的原子构成的A2B型极性分子,且是常见的溶剂,甲的电子式___ ,乙的化学式为_____ ;
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:___ 。

(1)若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子,Y原子的电子排布图为
(2)若X为非金属,甲是由两种短周期元素的原子构成的A2B型极性分子,且是常见的溶剂,甲的电子式
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
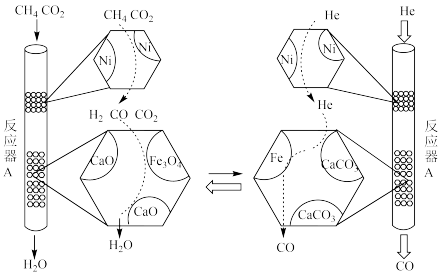
【推荐3】 还原重整
还原重整 既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、
既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、
(1)甲烷干法重整(1000℃)
ⅰ.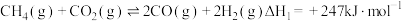
ⅱ.
①反应ⅰ的平衡常数表达式为______ 。
②对于反应ⅰ,既能加快反应速率又能提高 平衡转化率的措施是
平衡转化率的措施是_______ 。(写2条)反应ⅱ为副反应,生产中要尽可能控制该反应,减少水的生成。
(2)甲烷超干重整(750℃)


①
_______  。
。
② 的转化原理如下图所示:恒压、750℃时,将混合气
的转化原理如下图所示:恒压、750℃时,将混合气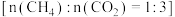 通入反应器
通入反应器 ,充分反应;待反应平衡后,改通
,充分反应;待反应平衡后,改通 气,吹出反应器
气,吹出反应器 内气体;如此往复切换通入的气体,实现
内气体;如此往复切换通入的气体,实现 的高效转化。
的高效转化。
ⅰ.基态 原子
原子 轨道能活化
轨道能活化 的简化电子排布式是
的简化电子排布式是________ 。
ⅱ.结合有关反应方程式,说明 对
对 氧化
氧化 反应的影响
反应的影响________ 。
ⅲ.反应达平衡后,改通 气,测得一段时间内
气,测得一段时间内 物质的量上升,解释
物质的量上升,解释 物质的量上升的原因
物质的量上升的原因___________ 。
(3)从能源利用的角度,分析甲烷超干重整法的优点:_______ 。
 还原重整
还原重整 既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、
既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、(1)甲烷干法重整(1000℃)
ⅰ.
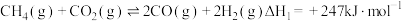
ⅱ.

①反应ⅰ的平衡常数表达式为
②对于反应ⅰ,既能加快反应速率又能提高
 平衡转化率的措施是
平衡转化率的措施是(2)甲烷超干重整(750℃)


①

 。
。②
 的转化原理如下图所示:恒压、750℃时,将混合气
的转化原理如下图所示:恒压、750℃时,将混合气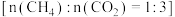 通入反应器
通入反应器 ,充分反应;待反应平衡后,改通
,充分反应;待反应平衡后,改通 气,吹出反应器
气,吹出反应器 内气体;如此往复切换通入的气体,实现
内气体;如此往复切换通入的气体,实现 的高效转化。
的高效转化。
ⅰ.基态
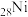 原子
原子 轨道能活化
轨道能活化 的简化电子排布式是
的简化电子排布式是ⅱ.结合有关反应方程式,说明
 对
对 氧化
氧化 反应的影响
反应的影响ⅲ.反应达平衡后,改通
 气,测得一段时间内
气,测得一段时间内 物质的量上升,解释
物质的量上升,解释 物质的量上升的原因
物质的量上升的原因(3)从能源利用的角度,分析甲烷超干重整法的优点:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+由H、C、N三种元素组成,结构如图甲所示。回答下列问题:
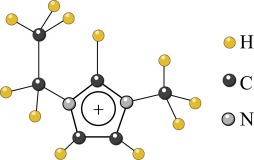
甲
(1)碳原子价层电子的轨道表达式为_____ ,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_____ 形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_____ 。NH3比PH3的沸点高,原因是_____ 。氮元素的第一电离能比同周期相邻元素都大的原因是_____ 。
(3)EMIM+中,碳原子的杂化轨道类型为_____ 。
(4)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于______ 晶体,其中硼原子的配位数为_____ 。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加 德罗常数的值为NA,则该晶胞中原子的空间利用率为_____ (列出化简后的计算式)。


甲
(1)碳原子价层电子的轨道表达式为
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是
(3)EMIM+中,碳原子的杂化轨道类型为
(4)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】硼、铝、镓、铟等第ⅢA族元素及其化合物在材料化学、工业生产和生活中具有广泛的应用。回答下列问题:
(1)基态镓原子核外价电子排布图为___________ ;同周期主族元素基态原子与其具有相同数目未成对电子的有___________ 。
(2)氨硼烷(NH3BH3)是目前最具潜力的储氢材料之一、
①氨硼烷晶体中B原子的杂化方式为___________ 。
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N-H∙∙∙H-B”表示。以下物质之间可能形成双氢键的是___________ (填序号)。
a.N2H4和AlH3 b.C3H6和C2H6 c.B2H6和HCN
(3)氟化铝和氯化铝的熔点分别为1090℃和192.6℃,它们熔点差异很大的原因可能是___________ 。
(4)硼酸盐常用于制作光学玻璃。一种无限网状结构的多聚硼酸根离子,其结构单元如图,若该硼酸根离子表示为(B5Ox)y-,则x=___________ ,y=___________ 。___________ 。
②设阿伏加德罗常数的值为NA,则该晶体密度为___________ g∙cm-3。(列出计算式即可)
(1)基态镓原子核外价电子排布图为
(2)氨硼烷(NH3BH3)是目前最具潜力的储氢材料之一、
①氨硼烷晶体中B原子的杂化方式为
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N-H∙∙∙H-B”表示。以下物质之间可能形成双氢键的是
a.N2H4和AlH3 b.C3H6和C2H6 c.B2H6和HCN
(3)氟化铝和氯化铝的熔点分别为1090℃和192.6℃,它们熔点差异很大的原因可能是
(4)硼酸盐常用于制作光学玻璃。一种无限网状结构的多聚硼酸根离子,其结构单元如图,若该硼酸根离子表示为(B5Ox)y-,则x=
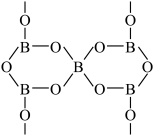
②设阿伏加德罗常数的值为NA,则该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)锰、锝、铼位于同一副族相邻周期,类比锰写出基态锝原子的价电子排布式___________ 。
(2)某镍配合物分子为平面结构,如图1所示,其中Ni的化合价是___________ ,配体中除氢外其它元素原子的第一电离能由大到小为___________ 。该配合物中Ni原子的杂化方式为___________ (填标号)。
A.sp B. C.
C. D.
D.

(3)配合物 常温下为液态,易溶于
常温下为液态,易溶于 等有机溶剂,固态
等有机溶剂,固态 属于
属于___________ 晶体,配体CO分子中有个___________ 个 键,CO做配体时配位原子是
键,CO做配体时配位原子是___________ ,原因是___________ 。
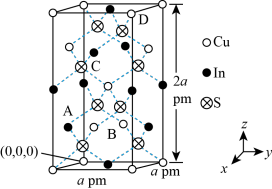
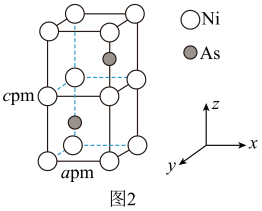
(4)Ni和As形成某种晶体的晶胞结构如图2所示,距离As最近的Ni构成正三棱柱,下方As原子坐标为 ( ,
, ,
, ),晶体中Ni的配位数为
),晶体中Ni的配位数为___________ ;NA为阿伏加德罗常数,则晶胞密度为___________ g/cm3 (列出计算式即可)。
(1)锰、锝、铼位于同一副族相邻周期,类比锰写出基态锝原子的价电子排布式
(2)某镍配合物分子为平面结构,如图1所示,其中Ni的化合价是
A.sp B.
 C.
C. D.
D.

(3)配合物
 常温下为液态,易溶于
常温下为液态,易溶于 等有机溶剂,固态
等有机溶剂,固态 属于
属于 键,CO做配体时配位原子是
键,CO做配体时配位原子是(4)Ni和As形成某种晶体的晶胞结构如图2所示,距离As最近的Ni构成正三棱柱,下方As原子坐标为 (
 ,
, ,
, ),晶体中Ni的配位数为
),晶体中Ni的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】I.8−羟基喹啉(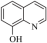 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
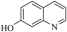 )、6−羟基喹啉(
)、6−羟基喹啉(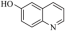 )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为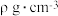 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。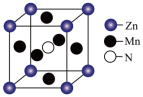
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
 距离最近且相等的
距离最近且相等的 有
有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
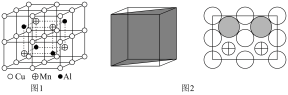
A.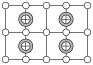 | B.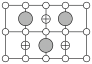 | C.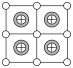 | D. |

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】W、Q、R、X、Y、Z六种元素的原子序数逐渐增大,已知W原子1s轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为msnmpn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是________ ,该分子中含有________ 个π键;
(2)Z原子的核外电子排布式为________ ;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为________ ;
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于________ 晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为________ (用元素符号回答);
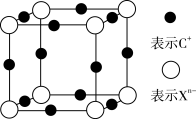
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示,该晶体中阳离子和阴离子个数比为________ ,晶体中每个Xn-被________ 个等距离的C+离子包围。
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是
(2)Z原子的核外电子排布式为
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示,该晶体中阳离子和阴离子个数比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】美国医学家证实了三价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的电子排布式为____________ 。
(2)O、N、S、Cr的第一电离能由大到小的顺序为_______________________ 。
(3)SO2分子的空间构型为________ , 中心原子的杂化方式为
中心原子的杂化方式为____________ 。
(4)CO2分子立体构型的为_________________ ,它的等电子体中属于分子的有________________ (任写一种)。
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·2H2O,该物质配离子中提供孤电子对的原子为____________ ,配位数为_______________ 。
(6)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加 德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞的棱长为_____________________ pm。

(1)Cr的电子排布式为
(2)O、N、S、Cr的第一电离能由大到小的顺序为
(3)SO2分子的空间构型为
 中心原子的杂化方式为
中心原子的杂化方式为(4)CO2分子立体构型的为
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·2H2O,该物质配离子中提供孤电子对的原子为
(6)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加 德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞的棱长为

您最近一年使用:0次



