依据下图中氮元素及其化合物的转化关系,回答问题:
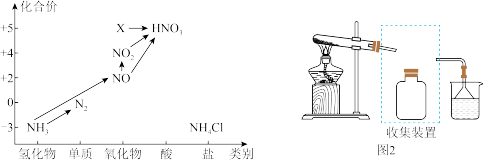
(1)图1中,X的化学式为_______ ,从化合价上看,X具有_______ 性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_______ 。
②下列试剂不能用于干燥NH3的是_______ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图_______ 。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式_______ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:_______ 。
②工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
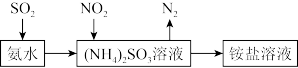
NO2被吸收过程的离子方程式是_______ 。
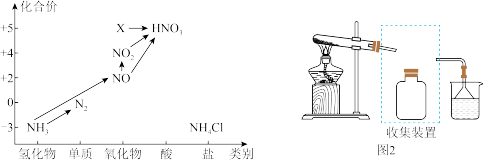
(1)图1中,X的化学式为
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
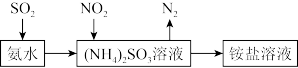
NO2被吸收过程的离子方程式是
更新时间:2021-04-13 08:31:27
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】亚氯酸钠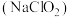 主要用于棉纺、造纸业的漂白剂,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如图:
主要用于棉纺、造纸业的漂白剂,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如图:
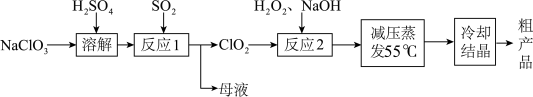
(1)提高“反应1”反应速率的措施有_______ (任写两条合理措施)。
(2)“反应1”中氧化剂与还原剂物质的量之比为_______ ,若通过原电池反应来实现“反应1”,正极的电极反应式为_______ 。
(3)“反应2”的化学方程式为_______ 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是_______ 。
(5)从“母液”中可回收的主要物质是_______ 。
(6)以某工业混合品(其中 百分含量为
百分含量为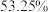 ,杂质不参与反应)为原料按照上述流程制取
,杂质不参与反应)为原料按照上述流程制取 的总回收率为
的总回收率为 。若利用
。若利用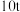 该工业混合品理论上得到
该工业混合品理论上得到 约
约_______  。(结果保留
。(结果保留 位小数。已知:
位小数。已知: 、
、 的相对分子质量分别是106.5,90.5)
的相对分子质量分别是106.5,90.5)
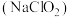 主要用于棉纺、造纸业的漂白剂,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如图:
主要用于棉纺、造纸业的漂白剂,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如图:
(1)提高“反应1”反应速率的措施有
(2)“反应1”中氧化剂与还原剂物质的量之比为
(3)“反应2”的化学方程式为
(4)采取“减压蒸发”而不用“常压蒸发”,原因是
(5)从“母液”中可回收的主要物质是
(6)以某工业混合品(其中
 百分含量为
百分含量为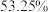 ,杂质不参与反应)为原料按照上述流程制取
,杂质不参与反应)为原料按照上述流程制取 的总回收率为
的总回收率为 。若利用
。若利用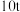 该工业混合品理论上得到
该工业混合品理论上得到 约
约 。(结果保留
。(结果保留 位小数。已知:
位小数。已知: 、
、 的相对分子质量分别是106.5,90.5)
的相对分子质量分别是106.5,90.5)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
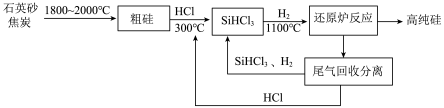
【推荐2】高纯硅广泛应用于信息技术和新能源技术等领域。改良西门子法生产高纯硅的流程如图所示,回答下列问题:___________ (填化学式),其与氢氟酸溶液反应的化学方程式为___________ 。
(2)制取粗硅时生成的气体为___________ (填化学式),粗硅与HCl反应的化学方程式为___________ 。
(3)还原炉中反应生成的氧化产物的电子式为___________ ,“还原炉反应”通入H2后加热前必须___________ ,以防造成严重后果。
(4)下列说法错误的是___________ (填标号)。
A.改良西门子法中H2、HCl的循环利用,体现了绿色化学思想
B.自然界中硅的存在的主要形式为石英砂
C.石英砂熔点高、硬度大是因为含有硅氧四面体结构
(2)制取粗硅时生成的气体为
(3)还原炉中反应生成的氧化产物的电子式为
(4)下列说法错误的是
A.改良西门子法中H2、HCl的循环利用,体现了绿色化学思想
B.自然界中硅的存在的主要形式为石英砂
C.石英砂熔点高、硬度大是因为含有硅氧四面体结构
您最近一年使用:0次
【推荐3】高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
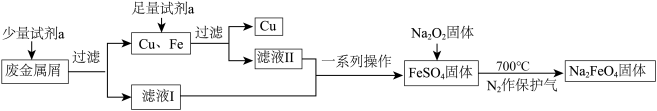
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的试剂是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。每生成1mol Na2FeO4转移的电子数为
2Na2FeO4+2Na2O+2Na2SO4+O2↑。每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为___________ 。

(1)试剂a为
(2)证明滤液I中无Fe3+的试剂是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。每生成1mol Na2FeO4转移的电子数为
2Na2FeO4+2Na2O+2Na2SO4+O2↑。每生成1mol Na2FeO4转移的电子数为(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】、下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
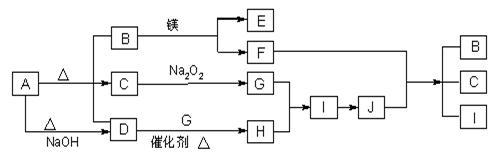
请填写以下空白:
(1)A的化学式_____________ B的电子式_______________ 。
(2)写出下列反应的化学方程式:
D+G→ H_____________________________ 。
F+J → B + C + I______________________________ 。
(3)写出A+NaOH→D的离子方程式______________________________ 。

请填写以下空白:
(1)A的化学式
(2)写出下列反应的化学方程式:
D+G→ H
F+J → B + C + I
(3)写出A+NaOH→D的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】如图是中学化学中常见四种物质在一定条件下的转化关系(其他产物已略去)。根据所学知识,回答下列问题:
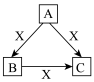
(1)若B、X都是气体单质,C遇空气变为红棕色气体,A遇湿润的红色石蕊试纸变蓝,A在纯氧气中点燃可生成单质B,则A是____ 。写出反应A→C的化学方程式_______
(2)若A是地壳中含量第二位的金属单质,X是一种常见最高价易挥发的含氧酸,常温下,发生如图转化关系,则X是____ (填化学名称),B是____ ,写出反应A→C的离子方程式:______ ;C→B的离子方程式:_______ 。

(1)若B、X都是气体单质,C遇空气变为红棕色气体,A遇湿润的红色石蕊试纸变蓝,A在纯氧气中点燃可生成单质B,则A是
(2)若A是地壳中含量第二位的金属单质,X是一种常见最高价易挥发的含氧酸,常温下,发生如图转化关系,则X是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO
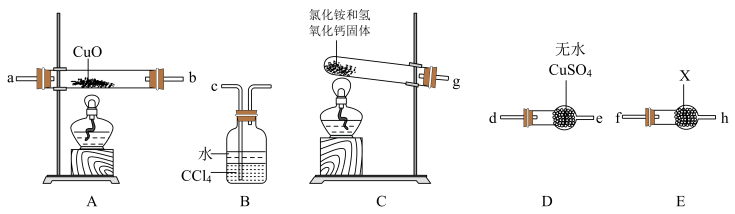
(1)装置C中发生的反应化学方程式为___________ 。
(2)试剂X为___________ 。
(3)请将提供的装置按合理顺序连接:g→___________ 。
(4)装置B的作用是___________ 。
(5)证明NH3能还原CuO的实验现象是___________ 。
Ⅱ.探究还原产物的成分
[查阅资料] Cu2O粉末呈红色,在酸性溶液中不稳定:
Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
[实验探究]
(6)
Ⅰ.验证NH3能还原CuO

(1)装置C中发生的反应化学方程式为
(2)试剂X为
(3)请将提供的装置按合理顺序连接:g→
(4)装置B的作用是
(5)证明NH3能还原CuO的实验现象是
Ⅱ.探究还原产物的成分
[查阅资料] Cu2O粉末呈红色,在酸性溶液中不稳定:
Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
[实验探究]
(6)
| 实验操作 | 实验现象 | 实验结论 |
| 取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | 证明红色固体为 |
| 若 | 证明红色固体肯定含有Cu2O,可能含有Cu |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】分类法是研究物质性质的重要方法。现有 、CO、
、CO、 、Cu、
、Cu、 、
、 等物质,根据它们的组成及性质进行如图分类:
等物质,根据它们的组成及性质进行如图分类:

请回答下列问题:
(1)淡黄色固体最终位于_______ 组,它的电子式为_______ 。该物质与水反应,若有 个电子转移,则有
个电子转移,则有_______ mol该物质参与反应。
(2)写出实验室制备Ⅰ组中气体的化学方程式_______ 。
(3)B组中的物质能与稀硝酸反应,写出该反应的离子方程式_______ 。
(4)Ⅱ组中的物质滴入水中后与水剧烈反应产生大量酸雾,写出该反应的化学方程式_______ 。
 、CO、
、CO、 、Cu、
、Cu、 、
、 等物质,根据它们的组成及性质进行如图分类:
等物质,根据它们的组成及性质进行如图分类:
请回答下列问题:
(1)淡黄色固体最终位于
 个电子转移,则有
个电子转移,则有(2)写出实验室制备Ⅰ组中气体的化学方程式
(3)B组中的物质能与稀硝酸反应,写出该反应的离子方程式
(4)Ⅱ组中的物质滴入水中后与水剧烈反应产生大量酸雾,写出该反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】A、B、C、D均为中学化学常见的纯净物且都含有一种相同元素,它们有如图所示转化关系。
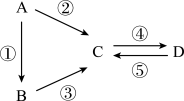
(1)常温下,A、B、C、D均为气体且A是无色无味的气体单质;在雷雨天气,可发生反应②。实验室制备气体B的化学反应方程式是_____ ,通常用试剂_____ 干燥气体B,欲吸收尾气中的B,下列装置中可选用_____ (填字母)。
A. B.
B. C.
C. D.
D.
反应⑤的离子方程式为_____ ;实验室欲吸收尾气中的D,通常选用的试剂是_____ 。
(2)若A是黄色固体单质,B为氢化物,D的浓溶液是一种无色黏稠油状液体。在加热条件下,D的浓溶液能与木炭发生反应生成C,写出该反应的化学方程式:_____ 。加入双氧水可实现反应④,写出该离子方程式___________ 。

(1)常温下,A、B、C、D均为气体且A是无色无味的气体单质;在雷雨天气,可发生反应②。实验室制备气体B的化学反应方程式是
A.
 B.
B. C.
C. D.
D.
反应⑤的离子方程式为
(2)若A是黄色固体单质,B为氢化物,D的浓溶液是一种无色黏稠油状液体。在加热条件下,D的浓溶液能与木炭发生反应生成C,写出该反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】“建设生态文明是中华民族永续发展的千年大计”。控制和治理NOx、SO2是解决光化学烟雾、减少酸雨、提高空气质量的有效途径,对构建生态文明有着极为重要的意义。
(1)NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图1所示:

SCR催化化反器中NH3还原NO2的程式为_______ 。
(2)用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
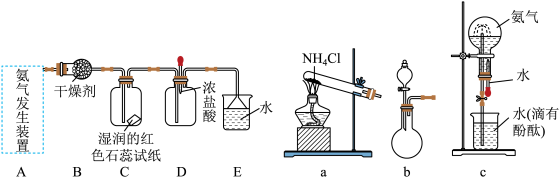
①若氨气的发生装置选择a,则其化学反应方程式为_______ 。
②若氨气的发生装置选择b,则所用的试剂为_______ 和_______ 。
③用c装置做氨气喷泉实验时,如果没有胶头滴管,请写出引发喷泉的简单操作是_______ 。
(3)为探究本地区雾霾中的可溶性粒的成分,某化学研究性小组进行了实验探究。
(查阅资料)粒样品中可能含有 、
、 、
、 、
、 、
、 、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)
、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)

请回答下列问题
①根据上述实验,雾浸取液中一定含有的离子为_______ ;肯定不含的离子为_______ 。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有_______ (填化学式)
(1)NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图1所示:

SCR催化化反器中NH3还原NO2的程式为
(2)用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

①若氨气的发生装置选择a,则其化学反应方程式为
②若氨气的发生装置选择b,则所用的试剂为
③用c装置做氨气喷泉实验时,如果没有胶头滴管,请写出引发喷泉的简单操作是
(3)为探究本地区雾霾中的可溶性粒的成分,某化学研究性小组进行了实验探究。
(查阅资料)粒样品中可能含有
 、
、 、
、 、
、 、
、 、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)
、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)
请回答下列问题
①根据上述实验,雾浸取液中一定含有的离子为
②若气体D遇空气会变成红棕色,则沉淀A中一定含有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室用如图所示的装置探究氯气的性质。E是硬质玻璃管装有细铁丝网。
请回答下列问题:

请回答下列问题:
(1)仪器A中发生的反应的化学方程式为
(2)装置C中的试剂是
(3)E中发生的反应的化学方程式是
(4)G中盛放的是NaOH溶液,G中发生反应的离子方程式为
(5)氯气可用于制备漂白粉,请用化学方程式解释漂白粉的漂白原理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】践行“绿水青山就是金山银山”的发展理念,就要做好大气污染和水污染防治:
(1)为落实“五水共治”,某工厂拟综合处理含 废水和工业废气(主要含
废水和工业废气(主要含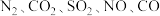 ,不考虑其他成分),设计了如图流程:
,不考虑其他成分),设计了如图流程:

①上述工业废气中可能造成环境污染的气体有___________ (至少写两种),固体Ⅰ含有的物质是___________ 。
②NaNO2溶液综合处理含 废水时,发生反应的离子方程式为
废水时,发生反应的离子方程式为___________ ;捕获剂所捕获的气体成分主要是___________ 。
(2)汽车尾气是城市的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使汽车尾气中的CO与NO2反应,生成无毒气体N2和CO2。
①写出上述反应的化学方程式:___________ 。
②某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去):
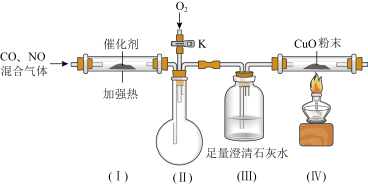
a.结合实验目的,装置(Ⅲ)的主要作用为___________ 。
b.该套装置中有一些不完善之处,如在装置(Ⅲ)与(Ⅳ)之间应加一气体干燥装置,还应在装置(Ⅳ)后添加___________ 。
(1)为落实“五水共治”,某工厂拟综合处理含
 废水和工业废气(主要含
废水和工业废气(主要含 ,不考虑其他成分),设计了如图流程:
,不考虑其他成分),设计了如图流程:
①上述工业废气中可能造成环境污染的气体有
②NaNO2溶液综合处理含
 废水时,发生反应的离子方程式为
废水时,发生反应的离子方程式为(2)汽车尾气是城市的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使汽车尾气中的CO与NO2反应,生成无毒气体N2和CO2。
①写出上述反应的化学方程式:
②某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去):

a.结合实验目的,装置(Ⅲ)的主要作用为
b.该套装置中有一些不完善之处,如在装置(Ⅲ)与(Ⅳ)之间应加一气体干燥装置,还应在装置(Ⅳ)后添加
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
(1)分解池中主要物质是_______________ 。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________ 。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________ 。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
①催化剂效果最佳的反应是________ (填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________ v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________ 。
④c点时该反应的平衡常数K =____________________ 。
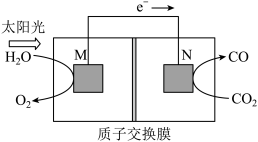
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________ 。
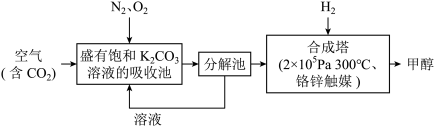
(1)分解池中主要物质是
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
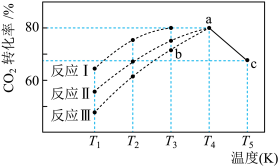
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是
②b点v (正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是
④c点时该反应的平衡常数K =
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为
您最近一年使用:0次



