下列方案设计、现象和结论都正确的是
| 选项 | 目的 | 方案设计 | 现象和结论 |
| A | 探讨影响化学平衡的因素 | 取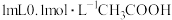 溶液于试管中,加入几滴甲基橙,再加少量 溶液于试管中,加入几滴甲基橙,再加少量 固体 固体 | 若溶液红色变浅或变成橙色,则说明增加 的浓度能使 的浓度能使 的电离平衡逆向移动 的电离平衡逆向移动 |
| B | 检验火柴头中氯元素的存在 | 摘下几根火柴的火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加 溶液、稀硝酸 溶液、稀硝酸 | 若未出现白色沉淀说明不含氯元素 |
| C | 标定NaOH溶液的浓度 | 精确称取邻苯二甲酸氢钾0.50g3份,分别放入3个250mL锥形瓶中,加入50mL蒸馏水,加入2滴酚酞指示剂,用待标定的NaOH标准溶液滴定 | 若滴定至溶液呈浅红色即达滴定终点,据此可计算出NaOH溶液的准确浓度 |
| D | 研究淀粉的水解程度 | 取0.5g淀粉于试管中,加入适量20%的硫酸溶液后沸水浴加热5min,再滴加过量氢氧化钠溶液,再加入适量碘水 | 若溶液没有变成蓝色,则淀粉已经水解完全 |
| A.A | B.B | C.C | D.D |
2021·浙江·模拟预测 查看更多[3]
浙江省普通高中强基联盟协作体2021届高三下学期统测化学试题(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷C(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用)
更新时间:2021-05-16 15:28:53
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列有关电解质溶液的说法正确的是
| A.用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质 |
| B.pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n |
| C.常温下,CH3COOH的Ka=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O的溶液中的c(OH-)相等 |
D.常温下,在0.10mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体, 的值增大且能使溶液的pH减小 的值增大且能使溶液的pH减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加适量的醋酸钠晶体后,两者的pH均增大 | B.温度都升高后,两者pH均增大 |
| C.用湿润的pH试纸测定出的pH值醋酸更大 | D.与足量锌反应两者产生的氢气一样多 |
您最近一年使用:0次
【推荐1】下列说法正确的是
| A.蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应 |
B. 和 和 为同一种物质 为同一种物质 |
| C.淀粉和纤维素的化学式均为(C6H10O5)n,故两者互为同分异构体 |
| D.间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是
| A.煤的干馏、石油的分馏都是化学变化 |
| B.溶于汽油、酒精等有机溶剂中的物质一定是有机物 |
| C.除去试管内壁上的“银镜”,可用稀氨水洗涤 |
| D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】有甲、乙、丙三种溶液,进行如下操作:

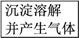


则甲、乙、丙三种溶液中加的溶质可能是( )
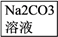
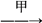

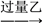


则甲、乙、丙三种溶液中加的溶质可能是( )
| A.BaCl2、H2SO4、MgCl2 | B.CaCl2、HNO3、AgNO3 |
| C.CaCl2、HNO3、NaCl | D.BaCl2、HCl、Na2CO3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】要求只用一种试剂来区别硫酸钠、氯化镁、氯化亚铁、硫酸铝四种溶液,这种试剂是( )
| A.氢氧化钠 | B.氢氧化钡 | C.氨水 | D.硝酸银 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法正确的是
| A.氯气、硫酸钡和氨水分别属于非电解质、强电解质和弱电解质 |
| B.体积不同但 pH 相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的 m 倍和 n 倍,稀 释后两溶液的 pH 仍相同,而 m 和 n 无法确定相对大小 |
| C.等 pH 等体积的醋酸和硫酸,分别与足量的碳酸氢钠反应,在相同条件下,硫酸放出气体更多 |
| D.用来配制标准 NaOH 溶液的 NaOH 固体含有少量的 KOH,此时中和测得盐酸的浓 度数值一定偏高 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】完成下列实验,所用仪器或操作合理的是
| A | B | C | D |
| 配制250 mL 0.10 mol·L−1NaOH溶液 | 除去工业乙醇中的杂质 | 除去粗盐水中的不溶物 | 用标准NaOH溶液滴定锥形瓶中的盐酸 |
 | 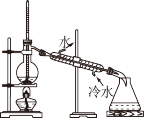 | 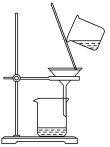 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是否含醛基
溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是否含醛基

