目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)Ni元素位于周期表中_________ 区,基态Ni2+外围电子排布图是____________ 。
(2)Ni(CO)4常用作制备高纯镍粉,常温下为液态,易溶于CCl4、苯等有机溶剂。则:
①Ni(CO)4固态时属于________ 晶体(填晶体类型)
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为____________ ,请事写出一种与CO互为等电子体的阴离子的化学式_________ 。
(3)NiSO4常用于电镀工业,丁二酮肟(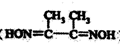 )是检验Ni2+的灵敏试剂,其中碳原子不存在
)是检验Ni2+的灵敏试剂,其中碳原子不存在_________ 杂化(填“sp”、“sp2”或“sp3”)。
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的________ 空隙中,已知晶胞边长为a pm,阿伏加德罗常数为NA,NiO晶体的密度为________ g/cm3(只列出计算式)。

(5)NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)________ r(Fe2+)(填“<”或“”>),请简述判断理由__________________________ 。
(1)Ni元素位于周期表中
(2)Ni(CO)4常用作制备高纯镍粉,常温下为液态,易溶于CCl4、苯等有机溶剂。则:
①Ni(CO)4固态时属于
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为
(3)NiSO4常用于电镀工业,丁二酮肟(
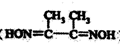 )是检验Ni2+的灵敏试剂,其中碳原子不存在
)是检验Ni2+的灵敏试剂,其中碳原子不存在(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的

(5)NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)
更新时间:2021-05-11 23:17:57
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

(1)基态硫原子价电子排布式为___________ 。
(2)O的非金属性强于S,从原子结构的角度解释其原因是___________ 。
(3)已知某种汞原子,其原子核内中子数是质子数的1.5倍,试判断Hg元素在周期表中的位置___________ 。
(4)化合物III也是一种汞解毒剂,其中电负性最大的元素是___________ ,S 原子采取的杂化方式为_____ 。
(5)相同物质的量的化合物I与化合物III相比溶于水后,形成的氢键更多的是___________ , 水溶性较好的是___________ 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是______ 。
②设X的最简式的式量为Mr,则X晶体的密度为___________ g/cm3(列出算式)。

(1)基态硫原子价电子排布式为
(2)O的非金属性强于S,从原子结构的角度解释其原因是
(3)已知某种汞原子,其原子核内中子数是质子数的1.5倍,试判断Hg元素在周期表中的位置
(4)化合物III也是一种汞解毒剂,其中电负性最大的元素是
(5)相同物质的量的化合物I与化合物III相比溶于水后,形成的氢键更多的是
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②设X的最简式的式量为Mr,则X晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】(I)多项选择题
下列说法中正确的是_______ 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________ 周期第________ 族;其基态原子的电子排布式为________ 。
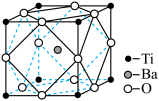
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是___________ ,其中Ti4+的氧配位数为________ ,Ba2+的氧配位数为_________ ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是_______ 晶体。
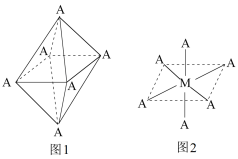
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有_______ 种同分异构体。
(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取______ 杂化。
(2)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+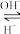 R(OH)3
R(OH)3 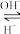 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_______________________ ;
②[R(OH)4]-中存在的化学键是____________ 。
A.离子键 B.极性键 C.非极性键 D.配位键
下列说法中正确的是
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有

(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
(2)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:

R3+
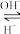 R(OH)3
R(OH)3 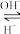 [R(OH)4]-
[R(OH)4]-①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示。

(1)写出基态Cu原子的核外电子排布式____ ,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____ (必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____ 。比较NH3和[Cu(NH3)4]2+中H-N-H中键角的大小:NH3_____ [Cu(NH3)4]2+(填“ ” “
” “ ”或“=”)。
”或“=”)。
(4)已知H2O2的结构如图:
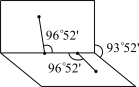
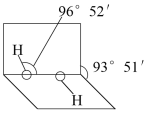
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______ 。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
结合数据说明CO比N2活泼的原因:_________ 。

(1)写出基态Cu原子的核外电子排布式
(2)写出胆矾晶体中水合铜离子的结构简式
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式
 ” “
” “ ”或“=”)。
”或“=”)。(4)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
| A—B | A=B | A=B | |
| CO | 357.7 | 798.9 | 1 071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
【推荐1】据《自然》杂志于2018年3月15日发布,中国留学生曹原用石墨烯实现了常温超导。这一发现将在很多领域发生颠覆性的革命。曹原被评为2018年度影响世界的十大科学人物的第一名。

(1)下列说法中正确的是______ 。
a.碳的电子式是 ,可知碳原子最外层有4个单电子
,可知碳原子最外层有4个单电子
b.12 g石墨烯含共价键数为NA
c.从石墨剥离得石墨烯需克服共价键
d.石墨烯中含有多中心的大π键
(2)COCl2分子的空间构型是___ 。其中,电负性最大的元素的基态原子中,有_________ 种不同能量的电子。
(3)独立的NH3分子中,H-N-H键键角106.70。如图是[Zn(NH3)6]2+离子的部分结构以及其中H-N-H键键角。

请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.50的原因是________ 。
(4)化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7℃,其中EMIM+结构如图所示。

该物质晶体的类型是_______ 。大π键可用符号 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为_______ 。
(5)碳化钙的电子式: ,其晶胞如图所示,晶胞边长为a nm、CaC2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为
,其晶胞如图所示,晶胞边长为a nm、CaC2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为___________ g·cm−3;晶胞中Ca2+位于C22-所形成的正八面体的体心,该正八面体的边长为______ nm。


(1)下列说法中正确的是
a.碳的电子式是
 ,可知碳原子最外层有4个单电子
,可知碳原子最外层有4个单电子b.12 g石墨烯含共价键数为NA
c.从石墨剥离得石墨烯需克服共价键
d.石墨烯中含有多中心的大π键
(2)COCl2分子的空间构型是
(3)独立的NH3分子中,H-N-H键键角106.70。如图是[Zn(NH3)6]2+离子的部分结构以及其中H-N-H键键角。

请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.50的原因是
(4)化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7℃,其中EMIM+结构如图所示。

该物质晶体的类型是
 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为(5)碳化钙的电子式:
 ,其晶胞如图所示,晶胞边长为a nm、CaC2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为
,其晶胞如图所示,晶胞边长为a nm、CaC2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】I.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①V2+基态时核外电子排布式为_______ 。
②C、N、O三种元素第一电离能从大到小的顺序是_______ 。
③下列说法正确的有_______ 。
A.C2H2、C2H4都是非极性分子 B.碳负离子 呈三角锥形
呈三角锥形
C.NO+电子式为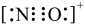 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子
(2)NaN3可用于汽车安全气囊。写出两种与 互为等电子体的分子或离子
互为等电子体的分子或离子_______ 。
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有_______ ,1mol该分子中含σ键的数目为_______ 。
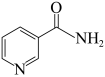
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(4)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中的空间利用率为_______ (用含a、b的式子表示)。
(5)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为_______ 。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①V2+基态时核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子 B.碳负离子
 呈三角锥形
呈三角锥形C.NO+电子式为
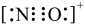 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子(2)NaN3可用于汽车安全气囊。写出两种与
 互为等电子体的分子或离子
互为等电子体的分子或离子(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(4)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中的空间利用率为
(5)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为
您最近一年使用:0次
【推荐3】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分为ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn基态原子核外电子排布式为___________ 。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42—互为等电子体的阴离子化学式为______ (写出一种)。
②氨的热稳定性强于膦(PH3),原因是_______ 。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是__________ 。
(4)《本草纲目》中记载炉甘石(主要成分为ZnCO3)可止血、消肿毒、生肌、明目等。Zn、C、O的电负性由大至小的顺序是______ 。
(1)Zn基态原子核外电子排布式为
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42—互为等电子体的阴离子化学式为
②氨的热稳定性强于膦(PH3),原因是
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是
(4)《本草纲目》中记载炉甘石(主要成分为ZnCO3)可止血、消肿毒、生肌、明目等。Zn、C、O的电负性由大至小的顺序是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钴是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钻盐的重要原料。Co2+和味唑(咪唑的结构为 ,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为
,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为
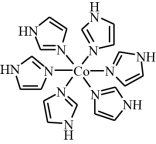 。
。
(1)基态Co原子的价电子轨道表达式为________ 。
(2)已知咪唑分子中N原子都为sp2杂化。下列关于咪唑的说法正确的是__________ 。
A咪唑分子中所有原子位于同一平面上
B味唑具有一定的碱性,与盐酸反应的化学方程式为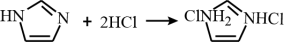
C1 mol咪唑分子中σ键数目为6NA
D味唑分子中只有极性共价键
(3)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。味唑分子中的大π键可表示为
)。味唑分子中的大π键可表示为________ 。
(4)离子[Co(im)6]2+中N与Co之间的化学键类型是________ ,判断的理由是________ 。
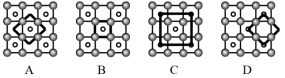
(5)某科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构,如图所示。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是__________ (填字母)。
(6)钻的一种化合物的晶胞结构如图所示:
 。
。
①已知A点的原子坐标参数为(0,0,0),C点为( ,
, ,
, ),则B点的原子坐标参数为
),则B点的原子坐标参数为_______ 。
②已知晶胞参数a=0.55nm,则该晶体的密度为__________ g/cm3(列出计算表达式即可)。
 ,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为
,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为 。
。(1)基态Co原子的价电子轨道表达式为
(2)已知咪唑分子中N原子都为sp2杂化。下列关于咪唑的说法正确的是
A咪唑分子中所有原子位于同一平面上
B味唑具有一定的碱性,与盐酸反应的化学方程式为
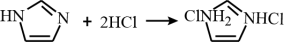
C1 mol咪唑分子中σ键数目为6NA
D味唑分子中只有极性共价键
(3)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。味唑分子中的大π键可表示为
)。味唑分子中的大π键可表示为(4)离子[Co(im)6]2+中N与Co之间的化学键类型是
(5)某科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构,如图所示。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是

(6)钻的一种化合物的晶胞结构如图所示:
 。
。 ①已知A点的原子坐标参数为(0,0,0),C点为(
 ,
, ,
, ),则B点的原子坐标参数为
),则B点的原子坐标参数为②已知晶胞参数a=0.55nm,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为______ 。N、O、S三种元素的第一电离能由大到小的顺序为________ (填元素符号)。
②Cu(NH3)4SO4中所含的化学键有_________ 。
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为_________ 。
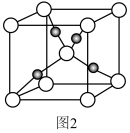
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图1所示),a位置上Cl原子的杂化轨道类型为_______ 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为_________ 。

(4)Cu2O晶胞结构如图2所示,该晶胞的边长为a cm,则Cu2O的密度为____ g·cm-3(用NA表示阿伏加德罗常数的数值)。
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②Cu(NH3)4SO4中所含的化学键有
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图1所示),a位置上Cl原子的杂化轨道类型为


(4)Cu2O晶胞结构如图2所示,该晶胞的边长为a cm,则Cu2O的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,其单质具有磁性,其化合物常用于制备电池导体。
(1)第二周期中基态原子与基态Co原子具有相同未成对电子数的元素是_______ 。
(2)Fe、Co、Ni原子半径相似、化学性质相似,原因是_______ 。
(3)配合物Fe(CO)5的中心原子价电子数与配体提供电子总数之和为_______ 。CO与N2互为等电子体,CO分子具有的化学键类型有_______ 。
A.σ键 B.π键 C.离子键 D.金属键
(4)Ni(CO)4的结构与相关性质如表,其空间构型为_______ ,Ni的杂化形式为_______ ,其为_______ 晶体。
(5)钙钛矿中含有Sm、Ni、O,它们形成的氧化物具有金属-绝缘体相转变特性,其晶胞结构中Sm和O如图所示,Ni位于O形成正八面体空隙中.晶胞边长为apm,设NA为阿伏加德罗常数的数值,则该氧化物的密度为_______ g•cm-3(列出计算表达式)。

(1)第二周期中基态原子与基态Co原子具有相同未成对电子数的元素是
(2)Fe、Co、Ni原子半径相似、化学性质相似,原因是
(3)配合物Fe(CO)5的中心原子价电子数与配体提供电子总数之和为
A.σ键 B.π键 C.离子键 D.金属键
(4)Ni(CO)4的结构与相关性质如表,其空间构型为
| 相对分子质量 | 熔点 | 沸点 | 结构 |
| 171 | -19.3℃ | 43℃ | 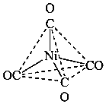 |
(5)钙钛矿中含有Sm、Ni、O,它们形成的氧化物具有金属-绝缘体相转变特性,其晶胞结构中Sm和O如图所示,Ni位于O形成正八面体空隙中.晶胞边长为apm,设NA为阿伏加德罗常数的数值,则该氧化物的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)我国秦俑彩绘上用的颜料被称为“中国蓝”(成分为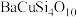 ),
),
①“中国蓝”中基态铜离子的价层电子排布式为_______ 。
② 的第三电离能远大于第二电离能,原因是
的第三电离能远大于第二电离能,原因是_______
(2)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①邻氨基吡啶的铜配合物中, 的配位数是
的配位数是_______ ,N原子的杂化类型为_______ 。
②1mol邻氨基吡啶 中
中 键的数目为
键的数目为_______ 。
(3) 可形成
可形成 ,其中
,其中 代表
代表 。
。
①该配合物分子中,VSEPR模型为四面体或正四面体的非金属原子共有_______ 个。
② 、B、H的电负性由大到小的顺序为
、B、H的电负性由大到小的顺序为_______ 。
(4)一种由 、
、 、
、 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:

若晶胞底边的边长均为a nm,高为c nm,阿加德罗常数的值为 ,设晶体的最简式的式量为M,则该晶体的密度为
,设晶体的最简式的式量为M,则该晶体的密度为_______  。
。
(1)我国秦俑彩绘上用的颜料被称为“中国蓝”(成分为
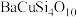 ),
),①“中国蓝”中基态铜离子的价层电子排布式为
②
 的第三电离能远大于第二电离能,原因是
的第三电离能远大于第二电离能,原因是(2)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①邻氨基吡啶的铜配合物中,
 的配位数是
的配位数是②1mol邻氨基吡啶
 中
中 键的数目为
键的数目为(3)
 可形成
可形成 ,其中
,其中 代表
代表 。
。①该配合物分子中,VSEPR模型为四面体或正四面体的非金属原子共有
②
 、B、H的电负性由大到小的顺序为
、B、H的电负性由大到小的顺序为(4)一种由
 、
、 、
、 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
若晶胞底边的边长均为a nm,高为c nm,阿加德罗常数的值为
 ,设晶体的最简式的式量为M,则该晶体的密度为
,设晶体的最简式的式量为M,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】ⅣA族元素(C、Si、Ge、Sn、Pb)及其化合物在材料等方面有重要用途。回答下列问题:
(1) Pb的价层电子排布图为:____________ ;
(2)GeC14的中心原子的价层电子对数为____________ ,分子的立体构型为___________ 。GeC14可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:________________________________ 。
(3)四卤化硅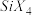 的沸点和二卤化铅
的沸点和二卤化铅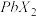 的熔点如下图所示。
的熔点如下图所示。
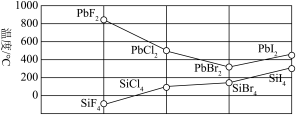
①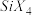 的沸点依F、CI、Br、I次序升高的原因是
的沸点依F、CI、Br、I次序升高的原因是____________ 。
②结合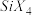 的沸点和
的沸点和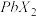 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序,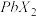 中化学键的离子性
中化学键的离子性__________ (填“增强”“不变”或“减弱”,下同)、共价性__________ 。
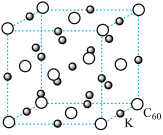
(4)碳的另一种单质 可以与钾形成低温超导化合物,晶胞结构如图所示。此化合物可看成是K填充在
可以与钾形成低温超导化合物,晶胞结构如图所示。此化合物可看成是K填充在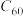 形成的所有四面体间隙和八面体间隙之中,其四面体间隙数目为
形成的所有四面体间隙和八面体间隙之中,其四面体间隙数目为_________ 。另有一种碱金属X(相对原子质量为M)与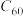 可形成类似化合物,但X只填充
可形成类似化合物,但X只填充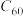 形成的八面体间隙的一半,此化合物的化学式为:
形成的八面体间隙的一半,此化合物的化学式为:__________ ,其晶胞参数为1.4nm,晶体密度为_________ 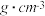 (用含M和阿伏伽德罗常数的值
(用含M和阿伏伽德罗常数的值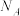 的式子表示)
的式子表示)
(1) Pb的价层电子排布图为:
(2)GeC14的中心原子的价层电子对数为
(3)四卤化硅
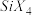 的沸点和二卤化铅
的沸点和二卤化铅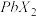 的熔点如下图所示。
的熔点如下图所示。
①
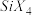 的沸点依F、CI、Br、I次序升高的原因是
的沸点依F、CI、Br、I次序升高的原因是②结合
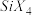 的沸点和
的沸点和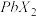 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序,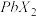 中化学键的离子性
中化学键的离子性
(4)碳的另一种单质
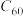 可以与钾形成低温超导化合物,晶胞结构如图所示。此化合物可看成是K填充在
可以与钾形成低温超导化合物,晶胞结构如图所示。此化合物可看成是K填充在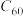 形成的所有四面体间隙和八面体间隙之中,其四面体间隙数目为
形成的所有四面体间隙和八面体间隙之中,其四面体间隙数目为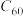 可形成类似化合物,但X只填充
可形成类似化合物,但X只填充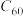 形成的八面体间隙的一半,此化合物的化学式为:
形成的八面体间隙的一半,此化合物的化学式为: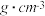 (用含M和阿伏伽德罗常数的值
(用含M和阿伏伽德罗常数的值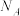 的式子表示)
的式子表示)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】锂离子电池是20世纪开发成功的新型高能电池,广泛应用于新能源汽车中。该电池的负极是石墨等材料,正极是 、
、 、
、 等材料。
等材料。
(1)Co元素在周期表中的位置是_______ 。
(2)下列微粒中半径比Li小的有_______。
(3) 的空间结构为
的空间结构为_______ 。
(4)第三电离能:Mn_______ Fe(选填“<”或“>”),原因是_______ 。
(5) 的晶胞如图所示。
的晶胞如图所示。

①已知A的坐标为(0,0,0),B的坐标为_______ 。
②设阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为_______  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 、
、 、
、 等材料。
等材料。(1)Co元素在周期表中的位置是
(2)下列微粒中半径比Li小的有_______。
| A.H | B.N | C.Na | D. |
 的空间结构为
的空间结构为(4)第三电离能:Mn
(5)
 的晶胞如图所示。
的晶胞如图所示。
①已知A的坐标为(0,0,0),B的坐标为
②设阿伏加德罗常数的值为
 ,则
,则 晶体的密度为
晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



