氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,从氧化还原反应的角度探究它们的性质。
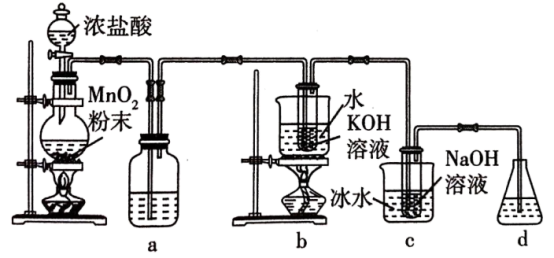
回答下列问题:
(1)盛放MnO2粉末的仪器名称是___________ ,a中的试剂为___________ 。
(2)b中采用的加热方式是___________ ,c中化学反应的离子方程式是___________ ,
(3)d的作用是___________
(4)反应结束后,取出b中试管,经冷却结晶,___________ ,___________ ,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显___________ 色。可知该条件下KClO3的氧化能力___________ NaClO(填“大于”或“小于”)。

回答下列问题:
(1)盛放MnO2粉末的仪器名称是
(2)b中采用的加热方式是
(3)d的作用是
(4)反应结束后,取出b中试管,经冷却结晶,
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显
更新时间:2021-05-12 15:44:51
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
(1)操作I加入X的目的是_______ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_______(填字母)。
(3)操作II的Y试剂为_______ (填化学式)。
(4)实验室在配制CuCl2溶液时需加入少许_______ (填物质名称),理由是(文字叙述并用有关离子方程式表示)_______ 。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_______ (填化学式);若要得无水CuCl2,请简述操作方法_______ 。

请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是
(2)下列物质都可以作为X,适合本实验的X物质可以是_______(填字母)。
| A.KMnO4 | B.NaClO | C.H2O2 | D.Cl2 |
(4)实验室在配制CuCl2溶液时需加入少许
(5)若将CuCl2溶液蒸干灼烧,得到的固体是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】ClO2和NaClO2都是广泛使用的漂白剂、消毒剂。其中高浓度ClO2气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产ClO2和NaClO2的工艺流程如下。
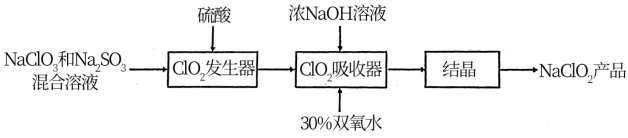
(1)Cl元素在周期表中的位置是_______ 。
(2)请写出ClO2发生器中反应的离子方程式_______ 。
(3)ClO2吸收器中,H2O2的作用是_______ 。
(4)若加硫酸过快,发生器中Na2SO3的利用率降低,请结合化学用语分析可能的原因_______ 。
(5)制备ClO2的工艺还有:
盐酸法
双氧水法
双氧水法相比盐酸法的优点有:反应需要的酸度条件较低,对设备腐蚀影响较小;_______ ;(补充一条优点)
(6)在碱性条件下,用ClO2无化处理含CN-废水,请写出此过程反应的离子方程式_______ 。

(1)Cl元素在周期表中的位置是
(2)请写出ClO2发生器中反应的离子方程式
(3)ClO2吸收器中,H2O2的作用是
(4)若加硫酸过快,发生器中Na2SO3的利用率降低,请结合化学用语分析可能的原因
(5)制备ClO2的工艺还有:
盐酸法

双氧水法

双氧水法相比盐酸法的优点有:反应需要的酸度条件较低,对设备腐蚀影响较小;
(6)在碱性条件下,用ClO2无化处理含CN-废水,请写出此过程反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含FeS、CuO、SiO2等杂质)制备NaBiO3的工艺流程如下图:

已知:
ⅰ.Bi3+易水解;NaBiO3难溶于冷水
ⅱ.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质
ⅲ.Cu(OH)2(s)+4NH3(g) Cu[(NH3)4]2+(aq)+2OH-(aq) K=4.4×10-7
Cu[(NH3)4]2+(aq)+2OH-(aq) K=4.4×10-7
ⅳ.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)“氧化浸取”时,氧化性:H2O2_______ S(填“>”或“<”);为抑制“氧化浸取”时Bi3+水解,可采取的措施是_______ 。
(2)“滤渣1”的主要成分是_______ (填化学式)。
(3)“氧化浸取”时,FeS转化为Fe3+的离子方程式是_______ 。
(4)“除铁”时,调节溶液pH值的范围是_______ 。
(5)“除铜”时发生反应:Cu2+(aq)+4NH3(g) Cu[(NH3)4]2+(aq) K=2×1013,则Ksp[Cu(OH)2]=
Cu[(NH3)4]2+(aq) K=2×1013,则Ksp[Cu(OH)2]=_______ 。
(6)“转化”时,生成NaBiO3的离子方程式是_______ 。“转化”后应冷却至室温再过滤,原因是_______ 。

已知:
ⅰ.Bi3+易水解;NaBiO3难溶于冷水
ⅱ.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质
ⅲ.Cu(OH)2(s)+4NH3(g)
 Cu[(NH3)4]2+(aq)+2OH-(aq) K=4.4×10-7
Cu[(NH3)4]2+(aq)+2OH-(aq) K=4.4×10-7ⅳ.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Bi3+ |
| 开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
| 沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)“氧化浸取”时,氧化性:H2O2
(2)“滤渣1”的主要成分是
(3)“氧化浸取”时,FeS转化为Fe3+的离子方程式是
(4)“除铁”时,调节溶液pH值的范围是
(5)“除铜”时发生反应:Cu2+(aq)+4NH3(g)
 Cu[(NH3)4]2+(aq) K=2×1013,则Ksp[Cu(OH)2]=
Cu[(NH3)4]2+(aq) K=2×1013,则Ksp[Cu(OH)2]=(6)“转化”时,生成NaBiO3的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。

已知: 易挥发,高温时能与
易挥发,高温时能与 反应,不与
反应,不与 反应,其他相关信息如下表所示:
反应,其他相关信息如下表所示:
回答下列问题:
(1)装置A中仪器b的名称是___________ ,装置E中的试剂是___________ (填试剂名称)。
(2)装置B中长导管a的作用是___________ 。
(3)装置A中发生反应的离子方程式___________ 。
(4)在通入 前,先打开开关k,从侧管持续通入一段时间的
前,先打开开关k,从侧管持续通入一段时间的 气体的目的是
气体的目的是___________ 。
(5)装置C中除生成 外,还生成一种气态不成盐氧化物,该反应的化学方程式为
外,还生成一种气态不成盐氧化物,该反应的化学方程式为________ 。
(6)利用如图装置测定所得 的纯度:取
的纯度:取 产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴 溶液作指示剂,用
溶液作指示剂,用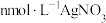 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。
。

已知:常温下,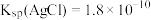 、
、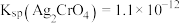 ,
, 呈砖红色,
呈砖红色,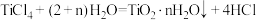 。
。
①安全漏斗中的水在本实验中的作用除与 反应外,还有
反应外,还有___________ ;
②产品的纯度为___________ (用含m、n和V的代数式表示)。
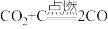 (夹持装置略去)。
(夹持装置略去)。
已知:
 易挥发,高温时能与
易挥发,高温时能与 反应,不与
反应,不与 反应,其他相关信息如下表所示:
反应,其他相关信息如下表所示:| 熔点/℃ | 沸点/℃ | 密度/( ) ) | 水溶性 | |
 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中仪器b的名称是
(2)装置B中长导管a的作用是
(3)装置A中发生反应的离子方程式
(4)在通入
 前,先打开开关k,从侧管持续通入一段时间的
前,先打开开关k,从侧管持续通入一段时间的 气体的目的是
气体的目的是(5)装置C中除生成
 外,还生成一种气态不成盐氧化物,该反应的化学方程式为
外,还生成一种气态不成盐氧化物,该反应的化学方程式为(6)利用如图装置测定所得
 的纯度:取
的纯度:取 产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴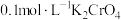 溶液作指示剂,用
溶液作指示剂,用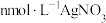 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。
。
已知:常温下,
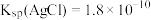 、
、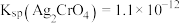 ,
, 呈砖红色,
呈砖红色,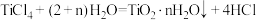 。
。①安全漏斗中的水在本实验中的作用除与
 反应外,还有
反应外,还有②产品的纯度为
您最近一年使用:0次
【推荐2】某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
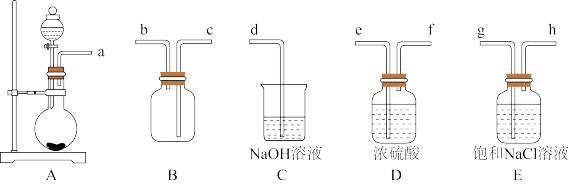
(1)若要制备纯净干燥的 ,按气流方向连接各仪器接口,顺序为
,按气流方向连接各仪器接口,顺序为_______ 。
a→_______→_______→_______→_______→_______→_______→d
(2)写出装置A中反应的化学方程式_______ ,该反应中盐酸起的作用是_______ 。
(3)若将A、B、C相连,制得 后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。
后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。
实验甲:甲同学用强光照射其中的一个试管中的氯水,同时使用数据采集器采集数据如下:

甲同学采集的数据是_______ (填字母)。
a.氯水的pH随时间的变化
b.溶液中氯离子浓度随时间的变化
c.液面上方氧气体积分数随时间的变化
实验乙:乙同学在另一试管的氯水中加入碳酸氢钠粉末,有无色气泡产生,乙指出氯气与水反应的产物具有酸性,甲同学认为不合理,原因是_______ 。
(4)由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯( )。我国广泛采用将经干燥空气稀释的氯气通入填有固体氯酸钠(
)。我国广泛采用将经干燥空气稀释的氯气通入填有固体氯酸钠(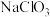 )的柱内制得
)的柱内制得 和另一种漂白物质,表示这一反应的化学方程式是
和另一种漂白物质,表示这一反应的化学方程式是_______ 。 为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是
为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是 的
的_______ 倍。
(5) 在处理含有
在处理含有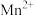 废水时,
废水时, 可将废水中的
可将废水中的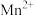 转化为
转化为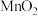 而除去,本身还原为
而除去,本身还原为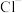 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。

(1)若要制备纯净干燥的
 ,按气流方向连接各仪器接口,顺序为
,按气流方向连接各仪器接口,顺序为a→_______→_______→_______→_______→_______→_______→d
(2)写出装置A中反应的化学方程式
(3)若将A、B、C相连,制得
 后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。
后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。实验甲:甲同学用强光照射其中的一个试管中的氯水,同时使用数据采集器采集数据如下:

甲同学采集的数据是
a.氯水的pH随时间的变化
b.溶液中氯离子浓度随时间的变化
c.液面上方氧气体积分数随时间的变化
实验乙:乙同学在另一试管的氯水中加入碳酸氢钠粉末,有无色气泡产生,乙指出氯气与水反应的产物具有酸性,甲同学认为不合理,原因是
(4)由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(
 )。我国广泛采用将经干燥空气稀释的氯气通入填有固体氯酸钠(
)。我国广泛采用将经干燥空气稀释的氯气通入填有固体氯酸钠(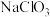 )的柱内制得
)的柱内制得 和另一种漂白物质,表示这一反应的化学方程式是
和另一种漂白物质,表示这一反应的化学方程式是 为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是
为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是 的
的(5)
 在处理含有
在处理含有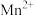 废水时,
废水时, 可将废水中的
可将废水中的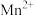 转化为
转化为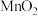 而除去,本身还原为
而除去,本身还原为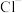 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取反应装置如图所示(夹持装置已略)。
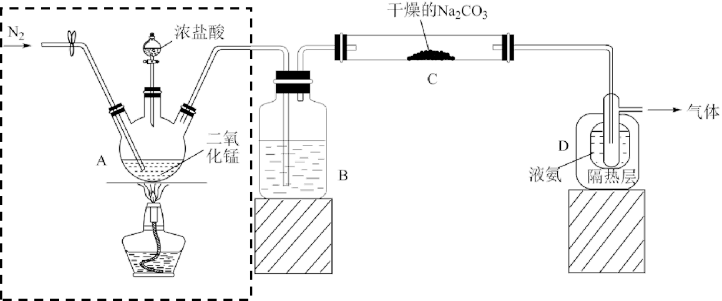
已知:Cl2O熔点为-116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。Cl2沸点为-34.6℃,液氨沸点为-33.5℃。
(1)实验室可利用MnO2和浓盐酸制备氯气,下列哪组物质也可用于实验室制备氯气___ 。
A.KClO3固体和浓盐酸 B.KMnO4固体和浓盐酸 C.NaCl固体和浓硫酸
(2)检查虚框中装置气密性的方法为:用止水夹夹住装置A两端的橡胶管,打开分液漏斗旋塞加水,若___ ,则装置的气密性良好。
(3)下列有关该实验的说法中,不正确 的是___ 。
(4)①装置C中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式___ 。
②液氨的作用是___ 。
(5)该实验装置存在一处明显的不足,其改进措施为___ 。

已知:Cl2O熔点为-116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。Cl2沸点为-34.6℃,液氨沸点为-33.5℃。
(1)实验室可利用MnO2和浓盐酸制备氯气,下列哪组物质也可用于实验室制备氯气
A.KClO3固体和浓盐酸 B.KMnO4固体和浓盐酸 C.NaCl固体和浓硫酸
(2)检查虚框中装置气密性的方法为:用止水夹夹住装置A两端的橡胶管,打开分液漏斗旋塞加水,若
(3)下列有关该实验的说法中,
| A.实验过程中,若MnO2过量,浓盐酸能被完全反应 |
| B.B中试剂是浓硫酸,目的是干燥氯气 |
| C.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险 |
| D.从装置D中逸出气体的主要成分是Cl2O |
②液氨的作用是
(5)该实验装置存在一处明显的不足,其改进措施为
您最近一年使用:0次
【推荐1】工业上制备BaCl2的工艺流程图如下:
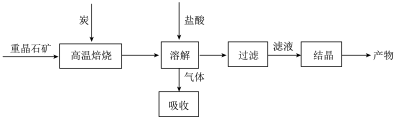
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________ 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,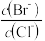 =
=__________ 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的 △H=
2CO(g)的 △H=________ kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_______________________________________ ,_____________________________________________ 。

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)
 4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①BaSO4(s) + 2C(s)
 2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
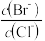 =
=[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)
 2CO(g)的 △H=
2CO(g)的 △H=(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】我国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为FeS2和FeCO3,实验室为测定FeS2和FeCO3的物质的量之比,利用如图所示装置进行实验。(已知:硫酸铜溶液与H2S反应生成CuS黑色沉淀),实验步骤如下:

I.按图示连接仪器,检查装置气密性后加入药品;
II.打开K1、K2,通入一段时间氮气,关闭K1、K2,取下干燥管E称其质量( m1 )后再连接好装置;
III.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质) ,待反应完成后,打开K2通入一段时间氮气;
IV.关闭K1、K2,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
V.取下干燥管E并称其质量(m2);
VI.取IV中所得溶液25.00mL于锥形瓶中,用0.200mol·L-1酸性KMnO4溶液滴定。
回答下列问题:
(1)装置A中盛稀硫酸的仪器的名称为___________ ;若撤去装置F,则测得的FeCO3的含量会___________ (填“偏大”“偏小”或“无影响”)。
(2)步骤III中反应完成后,打开K2通入一段时间氮气的目的是___________ 。
(3)实验过程中发现装置B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式:________ 。
(4)C装置的作用是___________ 。
(5)步骤VI中发生反应的离子方程式为___________ ,到达滴定终点的现象是___________ 。
(6)若上述实验中m2-m1=2.2 g,步骤VI消耗0. 200 mol·L-1酸性KMnO4溶液20. 00 mL,则该矿石样品中n( FeS2) :n( FeCO3)=___________ 。

I.按图示连接仪器,检查装置气密性后加入药品;
II.打开K1、K2,通入一段时间氮气,关闭K1、K2,取下干燥管E称其质量( m1 )后再连接好装置;
III.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质) ,待反应完成后,打开K2通入一段时间氮气;
IV.关闭K1、K2,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
V.取下干燥管E并称其质量(m2);
VI.取IV中所得溶液25.00mL于锥形瓶中,用0.200mol·L-1酸性KMnO4溶液滴定。
回答下列问题:
(1)装置A中盛稀硫酸的仪器的名称为
(2)步骤III中反应完成后,打开K2通入一段时间氮气的目的是
(3)实验过程中发现装置B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式:
(4)C装置的作用是
(5)步骤VI中发生反应的离子方程式为
(6)若上述实验中m2-m1=2.2 g,步骤VI消耗0. 200 mol·L-1酸性KMnO4溶液20. 00 mL,则该矿石样品中n( FeS2) :n( FeCO3)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:
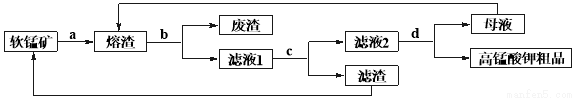
A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。

A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
您最近一年使用:0次



