某些醇和羧酸发生酯化反应过程如图,下列说法正确的是
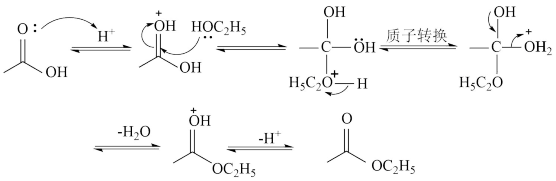

| A.该反应历程中,羧基碳原子存在sp2、sp3杂化方式的转化 |
| B.用同位素标记的C2H518OH与CH3COOH反应,18O同时出现在酯和水中 |
| C.酯化反应中加入浓硫酸,能够改变反应历程,但不能提高反应物转化率 |
| D.选择合适的催化剂,可以使反应物实现100%转化 |
更新时间:2021-05-28 13:42:18
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】向一容积可变密闭容器中充入等物质的量的A、B,发生反应: ,在不同压强下,该反应的平衡常数随温度的变化如表所示。下列判断
,在不同压强下,该反应的平衡常数随温度的变化如表所示。下列判断错误 的是
 ,在不同压强下,该反应的平衡常数随温度的变化如表所示。下列判断
,在不同压强下,该反应的平衡常数随温度的变化如表所示。下列判断| 压强/MPa 平衡常数 温度/℃ | 1.0 | 1.5 | 2.0 |
| 300 | a | b | 16 |
| 516 | c | 64 | d |
| 800 | 160 | f | g |
A.其他条件不变,反应速率: |
| B.正反应是吸热反应 |
C. 下,反应达平衡后,再充入Ar,A的转化率增大 下,反应达平衡后,再充入Ar,A的转化率增大 |
D. 时,B的转化率为 时,B的转化率为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列实验事实不能用平衡移动原理解释的是
| A.升高温度,水的离子积增大 |
| B.镁条与氯化铵溶液反应生成氢气 |
| C.排饱和食盐水法收集氯气 |
| D.加入少量硫酸铜可增大锌与稀硫酸反应的速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。

下列说法错误的是( )
 2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
下列说法错误的是( )
| A.0~60 s时段内,平均反应速率v(NO2)=0.002 0 mol·L-1·s-1 |
| B.60 s后,体系温度保持100 ℃,则混合气体的平均相对分子质量保持不变 |
| C.T ℃>100 ℃,第100 s时,c(N2O4)=0.020 mol·L-1 |
| D.100 s后,在T ℃将容器体积缩小为0.5 L,则正反应速率减小,逆反应速率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某恒定温度下,在一个2L的密闭容器中充入A气体,B气体,测得其浓度分别为2mol/L和1mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;2min后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是
4C(?)+2D(?)已知“?”代表C、D状态未确定;2min后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是
①该反应用C表示反应速率为1.2mol/(L•min)
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
 4C(?)+2D(?)已知“?”代表C、D状态未确定;2min后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是
4C(?)+2D(?)已知“?”代表C、D状态未确定;2min后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是①该反应用C表示反应速率为1.2mol/(L•min)
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
| A.①② | B.②③ | C.①④ | D.③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在一定条件下发生反应3A(g)+2B(g) zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得反应速率 v(D)=0.2 mol·L–1 ·min–1。则下列说法不正确的是
zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得反应速率 v(D)=0.2 mol·L–1 ·min–1。则下列说法不正确的是
 zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得反应速率 v(D)=0.2 mol·L–1 ·min–1。则下列说法不正确的是
zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得反应速率 v(D)=0.2 mol·L–1 ·min–1。则下列说法不正确的是| A.z=4 |
| B.B的转化率是40% |
| C.A的平衡浓度是1.4 mol·L–1 |
| D.平衡时气体压强是原来的1.2倍 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】有一种含氧杂环化合物,在合成有机材料和药品中有重要应用、其结构如下图所示。下列关于该有机物的说法不正确的是
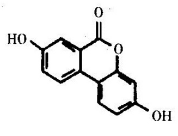

| A.1mol该有机物最多能消耗4mol NaOH |
| B.1mol该有机物与H2反应时,最多消耗6mol H2 |
| C.该有机物的苯环上的一氯代物有3种 |
| D.该分子所有原子可能处于同一平面上 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】2022年诺贝尔化学奖颁发给为点击化学发展做出贡献的3位科学家。点击反应的其中一种原料结构如图所示,下列说法不正确的是
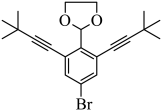
| A.该分子中有四种化学环境不同的氢原子 |
| B.该物质能使酸性高锰酸钾溶液和溴水褪色且原理相同 |
| C.该分子中碳原子有三种杂化方式 |
D. 该物质与 该物质与 反应,最多可消耗 反应,最多可消耗 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法不正确的是
| A.烷烃的熔、沸点一般随着分子中碳原子数的增加而升高 |
| B.C2H518OH与CH3COOH发生酯化反应,反应生成的水分子中不存在18O |
| C.不能用水区别乙醇、乙酸乙酯、CCl4三种有机试剂 |
| D.总物质的量为1mol的C3H6和C4H6O2的混合物,不论二者以何种比例混合,完全燃烧时消耗O2的量和生成H2O的量都不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】做下列有机实验时,操作正确的是
| A.检验某溶液中是否含有甲醛:在盛有2mL10%硫酸铜溶液的试管中滴加10%的氢氧化钠溶液0.5mL,混合均匀,滴入待检液后煮沸 |
| B.实验室制取硝基苯:先加入苯,再加浓硫酸,最后滴入浓硝酸 |
| C.制取溴苯:将铁屑、溴水和苯混合后共热 |
| D.制备乙酸正丁酯时,采用先反应,后分离的方法,采用15%的碳酸钠洗涤产品 |
您最近一年使用:0次

 2X2Y(g),平衡时生成0.6molX2Y。下列说法正确的是
2X2Y(g),平衡时生成0.6molX2Y。下列说法正确的是
 ,关于M的下列说法正确的是
,关于M的下列说法正确的是


