在醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使电离平衡左移且c(H+)减小,应采取的措施是
CH3COO-+H+,要使电离平衡左移且c(H+)减小,应采取的措施是
 CH3COO-+H+,要使电离平衡左移且c(H+)减小,应采取的措施是
CH3COO-+H+,要使电离平衡左移且c(H+)减小,应采取的措施是 | A.加入NaOH(s) | B.加入盐酸 | C.加蒸馏水 | D.降低温度 |
20-21高二下·山东淄博·期中 查看更多[9]
安徽省淮北市国泰中学2023-2024学年高二上学期期末考试化学试题天津市滨海新区田家炳中学2023-2024学年高二上学期期中考试化学试题吉林油田第十一中学2021-2022学年高二上学期期中考试化学试题(已下线)第14讲 弱电解质与电离平衡-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)陕西省西安市阎良区关山中学2021-2022学年高二上学期第三次质量检测化学(理)试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题课前-3.1 电离平衡-课前、课中、课后(人教版2019选择性必修1)(已下线)作业07 电离平衡-2021年高二化学暑假作业(人教版2019)山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题
更新时间:2021-05-13 13:27:27
|
相似题推荐
单选题
|
容易
(0.94)
名校
【推荐1】下列说法正确的是
| A.相同温度下,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3) |
B.CH3COOH 溶液加水稀释后,溶液中  的值减小 的值减小 |
| C.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
| D.100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】常温下,0.1mol·L-1某一元酸HA溶液中 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是| A.溶液中水电离出的c(H+)=10-10mol·L-1 |
| B.溶液中c(H+)+c(A-)=0.1mol·L-1 |
| C.常温下将HA稀释10倍,氢离子浓度变为原来的十分之一 |
| D.上述溶液加NaA晶体,溶液的c(OH-)增大 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐1】下列说法正确的是
| A.相同温度下,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3) |
B.CH3COOH 溶液加水稀释后,溶液中  的值减小 的值减小 |
| C.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
| D.100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】下列分析不正确 的是
| A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 |
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测中和热数值偏小 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐1】醋酸溶液中存在电离平衡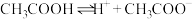 ,下列叙述不正确的是
,下列叙述不正确的是
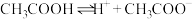 ,下列叙述不正确的是
,下列叙述不正确的是A.升高温度,平衡正向移动,醋酸的电离常数 增大 增大 |
B. 的 的 溶液中加水稀释,溶液的 溶液中加水稀释,溶液的 变大 变大 |
C. 溶液中加少量的 溶液中加少量的 固体,该电离平衡逆向移动 固体,该电离平衡逆向移动 |
D. 时,欲使醋酸溶液 时,欲使醋酸溶液 、电离常数 、电离常数 和电离程度都减小,可加入少量冰醋酸 和电离程度都减小,可加入少量冰醋酸 |
您最近一年使用:0次
单选题
|
容易
(0.94)
【推荐2】醋酸溶液中存在电离平衡:CH3COOH CH3COO-+ H+,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+ H+,要使电离平衡右移且c(H+)增大,应采取的措施是
 CH3COO-+ H+,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+ H+,要使电离平衡右移且c(H+)增大,应采取的措施是| A.加入NaOH(s) | B.加入盐酸 | C.加蒸馏水 | D.升高温度 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐1】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
 CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是| A.加少量烧碱固体 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】在0.01mol/L醋酸中存在下列平衡:CH3COOH H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是
H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是
 H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是
H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是| A.适当升高温度 | B.加入稀盐酸 | C.加入 CH3COONa固体 | D.加入少量水 |
您最近一年使用:0次

 结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L

