恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) ⇌2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值_______ 。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_______ 。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=_______ 。
(4)原混合气体中,a:b=_______ 。
(5)达到平衡时,n(N2):n(H2):n(NH3)=_______ 。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=
(4)原混合气体中,a:b=
(5)达到平衡时,n(N2):n(H2):n(NH3)=
11-12高二上·河北唐山·期中 查看更多[10]
福建省福州第一中学2022-2023学年高一下学期期末考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期期中考试化学试题吉林省延边第二中学2020-2021学年高一下学期期中考试化学试题河南省周口市中英文学校2020-2021学年高一下学期期中考试化学试题高中化学苏教2019版必修第二册-专题6 第一单元综合拔高练江西省南丰县第二中学2019-2020学年高一下学期4月线上测试化学试题江西省湘东中学2019~2020学年高一下学期期中化学线上能力测试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第三次月考化学试题(已下线)2014年高一化学人教版必修二 2-3-2化学反应的限度练习卷(已下线)2011-2012学年河北省唐山一中高二上学期期中考试化学(理)试卷
更新时间:2021-05-19 18:07:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】通过化学方法实现 的资源化利用是一种非常理想的
的资源化利用是一种非常理想的 减排途径。
减排途径。
Ⅰ.利用 制备CO
制备CO
一定温度下,在恒容密闭容器中进行反应: 。则:
。则:
(1)该反应的平衡常数表达式
_______ 。
(2)下列事实能说明上述反应达到化学平衡状态的是_______(填标号)。
Ⅱ.利用 制备甲醇(
制备甲醇( )
)
反应i:
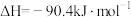 (主反应)
(主反应)
反应ii:
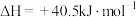 (副反应)
(副反应)
一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,发生上述反应。
,发生上述反应。 后反应达到平衡,此时容器中
后反应达到平衡,此时容器中 的物质的量为
的物质的量为 ,
, 的物质的量为
的物质的量为 。
。
(3)①平衡后 的浓度为
的浓度为_______ (用含a、b、V的代数式表示,下同) 。
。
②用CO的浓度变化表示0~ts内反应ii的反应速率,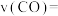
_______  。
。
③该条件下反应i的化学平衡常数为_______ 。
(4)探究温度和压强对平衡的影响(其他条件相同)不同压强下,平衡时 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
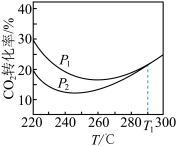
①压强
_______ (填“>”或“<”) 。
。
②图中温度高于 ℃时,两条曲线重叠的原因是
℃时,两条曲线重叠的原因是_______ 。
③下列条件对应的 平衡产率最大的是
平衡产率最大的是_______ (填标号)。
A.220℃,5MPa B.220℃,1MPa C.300℃,1MPa
 的资源化利用是一种非常理想的
的资源化利用是一种非常理想的 减排途径。
减排途径。Ⅰ.利用
 制备CO
制备CO一定温度下,在恒容密闭容器中进行反应:
 。则:
。则:(1)该反应的平衡常数表达式

(2)下列事实能说明上述反应达到化学平衡状态的是_______(填标号)。
A.体系内 | B.体系压强不再发生变化 |
| C.体系内各物质浓度不再发生变化 | D.体系内CO的物质的量分数不再发生变化 |
Ⅱ.利用
 制备甲醇(
制备甲醇( )
)反应i:

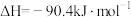 (主反应)
(主反应)反应ii:

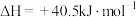 (副反应)
(副反应)一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,发生上述反应。
,发生上述反应。 后反应达到平衡,此时容器中
后反应达到平衡,此时容器中 的物质的量为
的物质的量为 ,
, 的物质的量为
的物质的量为 。
。(3)①平衡后
 的浓度为
的浓度为 。
。②用CO的浓度变化表示0~ts内反应ii的反应速率,
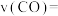
 。
。③该条件下反应i的化学平衡常数为
(4)探究温度和压强对平衡的影响(其他条件相同)不同压强下,平衡时
 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
①压强

 。
。②图中温度高于
 ℃时,两条曲线重叠的原因是
℃时,两条曲线重叠的原因是③下列条件对应的
 平衡产率最大的是
平衡产率最大的是A.220℃,5MPa B.220℃,1MPa C.300℃,1MPa
您最近半年使用:0次
【推荐2】合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨工业中原料气N2可以从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
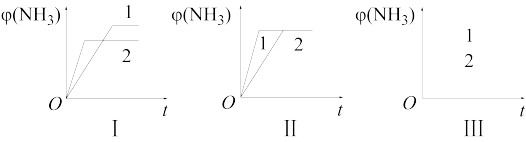
(1)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是_______(填字母)。
(2)将水蒸气通过红热的焦炭即产生水煤气,热化学方程式为C(s)+H2O(g)=H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。该反应在常温(298K)下_______ (填“能”或“不能”)自发进行。
(3)在一个容积为2L的密闭容器中,通入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是_______
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是_______

(4)从能量的变化和反应的快慢等角度探究反应:2H2+O2 2H2O。已知该反应为放热反应,下图能正确表示该反应中能量变化的是
2H2O。已知该反应为放热反应,下图能正确表示该反应中能量变化的是_______ (填“A”或“B”)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
则生成1mol水可以放出热量_______ kJ。
(5)以下反应:①木炭与水制备水煤气;②氯酸钾分解;③炸药爆炸;④酸与碱的中和反应;⑤生石灰与水作用制熟石灰;⑥Ba(OH)2·8H2O与NH4Cl反应。其中属于放热反应的有_______ (填序号)。
(1)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是_______(填字母)。

| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1 |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2 |
(3)在一个容积为2L的密闭容器中,通入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)
 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是_______
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是_______
| A.图中a点的值为0.15 |
| B.该反应的平衡常数K=0.03 |
| C.升高温度,平衡常数K减小 |
| D.平衡时A2的转化率为62.5% |
 2H2O。已知该反应为放热反应,下图能正确表示该反应中能量变化的是
2H2O。已知该反应为放热反应,下图能正确表示该反应中能量变化的是
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H-O |
| 键能/(kJ·mol-1) | 436 | 496 | 463 |
(5)以下反应:①木炭与水制备水煤气;②氯酸钾分解;③炸药爆炸;④酸与碱的中和反应;⑤生石灰与水作用制熟石灰;⑥Ba(OH)2·8H2O与NH4Cl反应。其中属于放热反应的有
您最近半年使用:0次
【推荐3】硫化氢(H2S)危害人体健康,造成环境污染。工业上可采用如下反应处理含H2S的尾气。请回答下列问题:
(1)已知:
I.S(g)+O2(g)=SO2(g) △H1=-314.27 kJ·mol-1;
II.2H2S(g)+O2(g)=2S(g)+2H2O(g) △H2=-407.07 kJ·mol-1
则2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=_____ ,1 mol S(s)完全燃烧放出的热量______ (填“>”“<”或“=”)314.27 kJ。
(2)H2S直接分解可制取H2:2H2S(g)⇌2H2(g)+S2(g) △H>0.一定温度下,起始压强为100 MPa,在体积为5 L的恒容密闭容器中充入1 mol H2S气体,发生该反应。
①下列说法可以判定该反应达到平衡状态的是___________ (填字母)。
A.H2S与H2的物质的量之比不再改变 B.气体的密度不再改变
C.断裂2 mol H-S键的同时断裂1 mol H-H键 D.气体的平均摩尔质量不再改变
②若10 min时反应达到平衡,压强变为原来的1.25倍,则从开始到平衡,v(H2)=___________ mol·L-1·min-1,H2S的转化率为___________ %,化学平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度表示,平衡分压=总压×物质的量分数)。
③若保持其他条件不变,将反应容器改为绝热恒容的密闭容器,则重新达到平衡时,S2(g)的体积分数与原平衡相比将___________ (填“增大”“减小”或“不变”)。
(3)H2S燃料电池的开发成功,使得H2S可以作为一种新型能源被资源化利用,基本工作原理如图所示。

①该电池工作时,负极的电极反应式为___________ 。
②已知1个电子的电量是1.602×10-19 C.则1 kg H2S输出的电量为____ (列出计算式即可)。
(1)已知:
I.S(g)+O2(g)=SO2(g) △H1=-314.27 kJ·mol-1;
II.2H2S(g)+O2(g)=2S(g)+2H2O(g) △H2=-407.07 kJ·mol-1
则2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=
(2)H2S直接分解可制取H2:2H2S(g)⇌2H2(g)+S2(g) △H>0.一定温度下,起始压强为100 MPa,在体积为5 L的恒容密闭容器中充入1 mol H2S气体,发生该反应。
①下列说法可以判定该反应达到平衡状态的是
A.H2S与H2的物质的量之比不再改变 B.气体的密度不再改变
C.断裂2 mol H-S键的同时断裂1 mol H-H键 D.气体的平均摩尔质量不再改变
②若10 min时反应达到平衡,压强变为原来的1.25倍,则从开始到平衡,v(H2)=
③若保持其他条件不变,将反应容器改为绝热恒容的密闭容器,则重新达到平衡时,S2(g)的体积分数与原平衡相比将
(3)H2S燃料电池的开发成功,使得H2S可以作为一种新型能源被资源化利用,基本工作原理如图所示。

①该电池工作时,负极的电极反应式为
②已知1个电子的电量是1.602×10-19 C.则1 kg H2S输出的电量为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度。
Ⅰ.实验一:探究温度和浓度对反应速率的影响。
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO +5SO
+5SO +2H+=I2+5SO
+2H+=I2+5SO +H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
(1)则V1=____ mL,V2=____ mL。
Ⅱ.实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验原理:2I-+2Fe3+ I2+2Fe2+。
I2+2Fe2+。
实验步骤:向5mL0.1mol·L-1KI溶液中滴加5~6滴0.1mol·L-1FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份。
(2)向甲中滴加CCl4,充分振荡、静置,下层溶液出现____ (填现象),说明有I2生成。
(3)向乙中滴加试剂____ ,若现象为___ ,则说明该反应有一定的限度。
Ⅲ.800℃时A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图,分析图象回答问题:
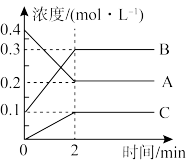
(4)该反应的化学方程式为____ 。
(5)2min内,用C来表示的化学反应速率为____ 。
(6)在其他条件下,测得A的反应速率为0.05mol·L-1·min-1,此时的反应与800℃时相比,____ (填字母)。
A.比800℃时快 B.比800℃时慢 C.和800℃时速率一样
Ⅰ.实验一:探究温度和浓度对反应速率的影响。
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO
 +5SO
+5SO +2H+=I2+5SO
+2H+=I2+5SO +H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。| 实验序号 | 0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
Ⅱ.实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验原理:2I-+2Fe3+
 I2+2Fe2+。
I2+2Fe2+。实验步骤:向5mL0.1mol·L-1KI溶液中滴加5~6滴0.1mol·L-1FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份。
(2)向甲中滴加CCl4,充分振荡、静置,下层溶液出现
(3)向乙中滴加试剂
Ⅲ.800℃时A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图,分析图象回答问题:

(4)该反应的化学方程式为
(5)2min内,用C来表示的化学反应速率为
(6)在其他条件下,测得A的反应速率为0.05mol·L-1·min-1,此时的反应与800℃时相比,
A.比800℃时快 B.比800℃时慢 C.和800℃时速率一样
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
(1)探究不同条件下空气中氧气氧化KI的速率。
①酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______ 。
②设计实验组别3的目的是_______ 。
(2)探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:

①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:_______ ;乙同学认为该现象无法证明该反应为可逆反应,原因为:_______ 。
②请选择上述试剂重新设计实验,证明该反应为可逆反应:_______ 。
Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:
(3)NaH2PO2属于_______ (填“正盐”“酸式盐”或“无法确定”)。
(4)设计实验方案,证明次磷酸是弱酸:_______ 。
(1)探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298 K | 0.1 mol/L | 5 mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
| 2 | 313 K | 0.1 mol/L | 5 mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
| 3 | 298 K | 0.1 mol/L | 10 mL | 0.1 mol/L | 5 mL | 5 mL | 3滴 |
②设计实验组别3的目的是
(2)探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:

①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:
②请选择上述试剂重新设计实验,证明该反应为可逆反应:
Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:
(3)NaH2PO2属于
(4)设计实验方案,证明次磷酸是弱酸:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。_____ I-+___ Fe3+
______ I2+_______ Fe2+
(2)步骤ⅲ中,试剂X是_____________ 。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是_________ 。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。

(2)步骤ⅲ中,试剂X是
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是
您最近半年使用:0次



