硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为_______ ,晶体硅和碳化硅熔点较高的是_______ (填化学式);
(2)硅和卤素单质反应可以得到 ,
, 的熔沸点如下表:
的熔沸点如下表:
①0℃时, 、
、 、
、 、
、 呈液态的是
呈液态的是____ (填化学式),沸点依次升高的原因是_____ ,气态 分子的空间构型是
分子的空间构型是_______ ;
② 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为_______ ,H、C、N的电负性由大到小的顺序为_______ ,1个 中含有
中含有_______ 个 键;
键;
(3)下图是 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
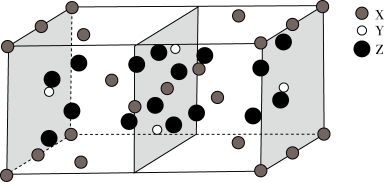
①已知化合物中 和
和 的原子个数比为1:4,图中Z表示
的原子个数比为1:4,图中Z表示_______ 原子(填元素符号),该化合物的化学式为_______ ;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度
,则该晶体的密度
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
(1)基态硅原子最外层的电子排布图为
(2)硅和卤素单质反应可以得到
 ,
, 的熔沸点如下表:
的熔沸点如下表: |  |  |  | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
 、
、 、
、 、
、 呈液态的是
呈液态的是 分子的空间构型是
分子的空间构型是②
 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为
 中含有
中含有 键;
键;(3)下图是
 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
①已知化合物中
 和
和 的原子个数比为1:4,图中Z表示
的原子个数比为1:4,图中Z表示②已知该晶胞的晶胞参数分别为anm、bnm、cnm,
 ,则该晶体的密度
,则该晶体的密度
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
2021·湖南·高考真题 查看更多[14]
2021年新高考湖南化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年湖南省高考化学试卷变式题11-19(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编山东省菏泽市单县第二中学2021-2022学年高二3月月考化学试题(已下线)第五章 物质结构与性质 元素周期律 第32讲 物质结构与性质综合题研究(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
更新时间:2021-06-09 15:25:16
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
【推荐1】磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是_______ (用元素符号作答)。
(2)基态磷原子的电子排布式为_______ 。
(3)图2中,黑磷区P原子的杂化方式为_______ ,石墨区C原子的杂化方式为_______ 。
(4)氢化物PH3、CH4、NH3的沸点最高的是_______ ,原因是_______ 。
(5)根据图1和图2的信息,下列说法正确的有_______ (填字母)。
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生_______ (填“物理”或“化学” )变化。
②相同条件下,电极材料_______ ( 填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是_______ 。
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______ g·cm-3(列出计算式)。
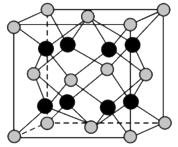
图3

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是
(2)基态磷原子的电子排布式为
(3)图2中,黑磷区P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点最高的是
(5)根据图1和图2的信息,下列说法正确的有
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生
②相同条件下,电极材料
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

图3
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】过渡元素铁、铜、锌的单质及其化合物在工农业、国防、科技等领域具有广泛应用。
回答下列问题:
(1)FeCO3的熔点为169℃,沸点为334℃,可用于制备纯铁。
①Fe元素位于元素周期表的______ (填“s”、“p”、“d”或“ds”)区。
②电负性:C______ (填“>”或“<”)O。
③CO 的空间结构为
的空间结构为______ 。
④大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π 。已知CO
。已知CO 中存在大π键,该大π键可表示为
中存在大π键,该大π键可表示为_______ 。
(2)Cu2O与稀硫酸反应生成Cu和CuSO4。铜的晶胞结构如图所示。

①基态硫原子的价层电子排布式为______ ,SO 的中心原子的杂化方式为
的中心原子的杂化方式为______ 。
②铜晶胞在x轴方向的投影图是______ (填标号)。
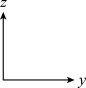
A.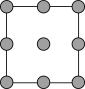 B.
B.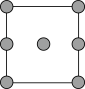 C.
C.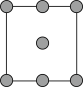 D.
D.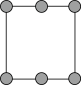
③假设铜晶胞参数为anm,铜晶体的密度为bg•cm-3,则铜的相对原子质量为______ (设NA为阿伏加德罗常数的值,用含a、b、NA的代数式表示)。
(3)ZnS是一种半导体材料,其晶胞结构如图所示。

①锌元素在元素周期表中的位置为______ 。
②已知A点的原子坐标参数为(0,0,0),B点的原子坐标参数为(1,1,1),则C点的原子坐标参数为______ 。
回答下列问题:
(1)FeCO3的熔点为169℃,沸点为334℃,可用于制备纯铁。
①Fe元素位于元素周期表的
②电负性:C
③CO
 的空间结构为
的空间结构为④大π键可用符号Π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π 。已知CO
。已知CO 中存在大π键,该大π键可表示为
中存在大π键,该大π键可表示为(2)Cu2O与稀硫酸反应生成Cu和CuSO4。铜的晶胞结构如图所示。

①基态硫原子的价层电子排布式为
 的中心原子的杂化方式为
的中心原子的杂化方式为②铜晶胞在x轴方向的投影图是

A.
 B.
B. C.
C. D.
D.
③假设铜晶胞参数为anm,铜晶体的密度为bg•cm-3,则铜的相对原子质量为
(3)ZnS是一种半导体材料,其晶胞结构如图所示。

①锌元素在元素周期表中的位置为
②已知A点的原子坐标参数为(0,0,0),B点的原子坐标参数为(1,1,1),则C点的原子坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____ (填元素符号),其中C原子的核外电子排布式为_____ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式);A和B的氢化物所属的晶体类型分别为_____ 和_____ 。
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为_____ ,中心原子的杂化轨道类型为_____ 。
(4)化合物D2A的中心原子的价层电子对数为_____ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____ 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_____ ;晶胞中A原子的配位数为_____ 。
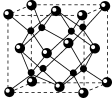
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为
(4)化合物D2A的中心原子的价层电子对数为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
①硫酸浸取液中的金属离子主要是 ,其次是
,其次是 、
、 和
和 ;
;
②常温下,部分金属离子以氢氧化物形式沉淀时溶液的pH如表:
回答下列问题:
(1)“酸浸”时,为了提高浸取率,可采取的措施有___________ (写出一条)。
(2)在实验室进行“过滤”操作时所用玻璃仪器除烧杯外,还需要___________ 。
(3)基态Cr原子的价层电子排布式为___________ ,Fe在元素周期表中的位置:___________ 。
(4) 的作用是将滤液Ⅰ中的
的作用是将滤液Ⅰ中的 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(5)1mol 配离子中含
配离子中含 键的数目为
键的数目为___________ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(6)“调pH=8”后“过滤Ⅱ”得到的滤渣主要成分为___________ (填化学式)。
(7)钠离子交换树脂的反应原理为 ,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有 还有
还有___________ (填离子符号,下同),交换后溶液中浓度明显增大的离子为___________ 。
(8)“还原”步骤后,检验 的氧化产物方法是:
的氧化产物方法是:___________ 。
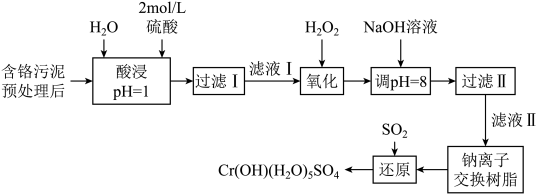
①硫酸浸取液中的金属离子主要是
 ,其次是
,其次是 、
、 和
和 ;
;②常温下,部分金属离子以氢氧化物形式沉淀时溶液的pH如表:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 2.2 | 9.6 | 10.8 | 4.6 |
| 沉淀完全时的pH | 3.7 | 11.6 | 12 | 5.9 |
(1)“酸浸”时,为了提高浸取率,可采取的措施有
(2)在实验室进行“过滤”操作时所用玻璃仪器除烧杯外,还需要
(3)基态Cr原子的价层电子排布式为
(4)
 的作用是将滤液Ⅰ中的
的作用是将滤液Ⅰ中的 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(5)1mol
 配离子中含
配离子中含 键的数目为
键的数目为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(6)“调pH=8”后“过滤Ⅱ”得到的滤渣主要成分为
(7)钠离子交换树脂的反应原理为
 ,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有 还有
还有(8)“还原”步骤后,检验
 的氧化产物方法是:
的氧化产物方法是:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】A、B、M是生活中最常见的前四周期金属元素,A元素的单质既可与强酸反应也可与强碱反应,B位于周期表的第八纵行,其+3价离子比+2价离子在水溶液中稳定,M原子的价电子排布为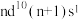 。回答下列问题:
。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为___________ 。
(2)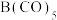 为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。
为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。 更接近于
更接近于___________ (填晶体类型)。下列说法错误的是___________ (填标号)。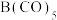 中B的化合价为0
中B的化合价为0
B.配体与B原子所形成的配位键的键能相同
C.B在周期表中位于VIII族,属于d区元素
D.制备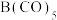 应在隔绝空气的条件下进行
应在隔绝空气的条件下进行
(3) 中存在的
中存在的 键有
键有___________ mol。 具有对称的空间结构,其中2个
具有对称的空间结构,其中2个 分别被
分别被 取代能得到两种不同结构的
取代能得到两种不同结构的 ,则
,则 中由4个
中由4个 围成的图形是
围成的图形是___________ 。
(4)金属A与M可形成多种组成不同的合金,其中一种合金的晶胞如图甲所示(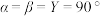 ),图乙为晶胞在z轴方向的投影。
),图乙为晶胞在z轴方向的投影。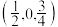 ,则b点原子的分数坐标为
,则b点原子的分数坐标为___________ 。
②该晶体的密度为___________  (用含NA的计算式回答)。
(用含NA的计算式回答)。
(5) 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为___________ 。
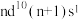 。回答下列问题:
。回答下列问题:(1)
 的价电子排布式为
的价电子排布式为(2)
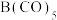 为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。
为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。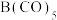 更接近于
更接近于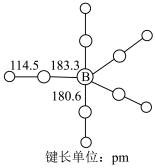
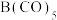 中B的化合价为0
中B的化合价为0B.配体与B原子所形成的配位键的键能相同
C.B在周期表中位于VIII族,属于d区元素
D.制备
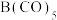 应在隔绝空气的条件下进行
应在隔绝空气的条件下进行(3)
 中存在的
中存在的 键有
键有 具有对称的空间结构,其中2个
具有对称的空间结构,其中2个 分别被
分别被 取代能得到两种不同结构的
取代能得到两种不同结构的 ,则
,则 中由4个
中由4个 围成的图形是
围成的图形是(4)金属A与M可形成多种组成不同的合金,其中一种合金的晶胞如图甲所示(
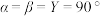 ),图乙为晶胞在z轴方向的投影。
),图乙为晶胞在z轴方向的投影。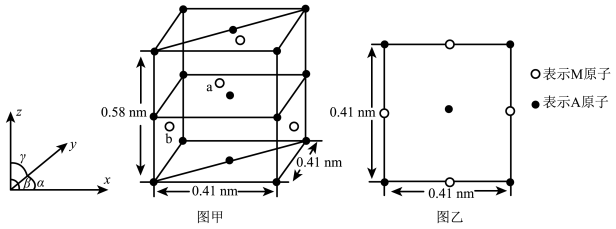
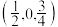 ,则b点原子的分数坐标为
,则b点原子的分数坐标为②该晶体的密度为
 (用含NA的计算式回答)。
(用含NA的计算式回答)。(5)
 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
(2)二茂铁属于___________________ 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________ (选填“a”或“b”)

(3)环戊二烯( )中C的杂化方式
)中C的杂化方式 _______________ 。1mol环戊二烯中含有σ键的数目为___________ 。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________ 。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
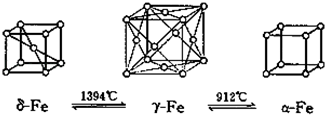
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____ (用代数式表示,不要求算出具体结果)。
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为
(2)二茂铁属于

(3)环戊二烯(
 )中C的杂化方式
)中C的杂化方式 (4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同

(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm-3,晶胞边长为4.28×10-10 m,则FexO中x=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态Se原子的的核外电子排布式为___________
(2)O、S、Se原子的第一电离能由大到小的顺序为___________ 。
(3)H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(4)H2Se的酸性比H2S________ (填“强”或“弱”),气态 分子的立体构型为
分子的立体构型为_______ , 离子的中心原子的杂化类型为
离子的中心原子的杂化类型为___________ ;
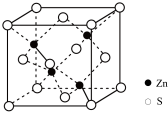
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方 晶体结构如下图所示,S原子的配位数是
晶体结构如下图所示,S原子的配位数是___________ ,已知晶胞边长为 ,NA代表阿伏加德罗常数,则其密度为
,NA代表阿伏加德罗常数,则其密度为___________ (列式并计算)。
(6)定影液的主要成分是 ,它能溶解胶皮上为感光的
,它能溶解胶皮上为感光的 ,从而起到一定影响作用,为使定影液再生,进行如下的处理:
,从而起到一定影响作用,为使定影液再生,进行如下的处理:
① 在
在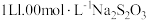 溶液中溶解的质量为
溶液中溶解的质量为___________ g。[已知 ,
,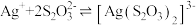 的平衡常数
的平衡常数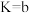 ]
]
②写定影液再生的离子方程式为___________ 。
(1)基态Se原子的的核外电子排布式为
(2)O、S、Se原子的第一电离能由大到小的顺序为
(3)H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(4)H2Se的酸性比H2S
 分子的立体构型为
分子的立体构型为 离子的中心原子的杂化类型为
离子的中心原子的杂化类型为(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方 晶体结构如下图所示,S原子的配位数是
晶体结构如下图所示,S原子的配位数是 ,NA代表阿伏加德罗常数,则其密度为
,NA代表阿伏加德罗常数,则其密度为
(6)定影液的主要成分是
 ,它能溶解胶皮上为感光的
,它能溶解胶皮上为感光的 ,从而起到一定影响作用,为使定影液再生,进行如下的处理:
,从而起到一定影响作用,为使定影液再生,进行如下的处理:
①
 在
在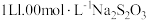 溶液中溶解的质量为
溶液中溶解的质量为 ,
,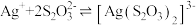 的平衡常数
的平衡常数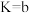 ]
]②写定影液再生的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为_______ ;与N同周期的主族元素中,电负性大于N的有 _______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与N 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:_______ ,N 的空间构型为
的空间构型为 _______ 。
(3)据报道,美国科学家卡尔•克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是_______ 。
(4)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),已知N
),已知N 为平面结构且含有大π键,则N
为平面结构且含有大π键,则N 中的大π键应表示为
中的大π键应表示为 _______ 。
②图中虚线代表氢键,其表示式为(NH )N﹣H•••Cl、
)N﹣H•••Cl、_______ 、_______ 。
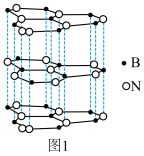
(5)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______ 。该氮化硼晶体具有良好的润滑性,其原因是 _______ 。
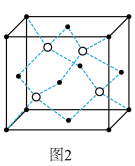
(6)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。一个晶胞中所含B原子的数目为_______ ;已知晶体的密度为dg•cm﹣3,NA为阿伏加德罗常数的值,则晶胞边长为 _______ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与N
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: 的空间构型为
的空间构型为 (3)据报道,美国科学家卡尔•克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是
(4)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号Π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),已知N
),已知N 为平面结构且含有大π键,则N
为平面结构且含有大π键,则N 中的大π键应表示为
中的大π键应表示为 ②图中虚线代表氢键,其表示式为(NH
 )N﹣H•••Cl、
)N﹣H•••Cl、(5)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(6)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。一个晶胞中所含B原子的数目为

您最近一年使用:0次
【推荐3】I.元素周期表中80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是_____ ,N2F2分子中N原子的杂化方式是_______ ,1mol N2F2含有____ 个δ键。
(2)高温陶瓷材料Si3N4晶体中N-Si-N的键角大于Si-N-Si的键角,原因是_______ 。
II.金属元素铁、铜及其化合物在日常生产、生活有着广泛的应用。
(1)铁在元素周期表中的位置_________ 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_____ (填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子吸之和为18,则x=________ 。
(3)N2是CO的一种等电子体,两者相比较沸点较高的为_______ (填化学式)。
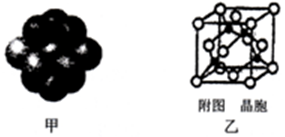
(4)铜晶体中铜原子的堆积方式如下图甲所示。
①基态铜原子的核外电子排布式为___________ 。
② 每个铜原子周围距离最近的铜原子数目为___________ 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如下图乙所示(黑点代表铜原子)。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________ pm。(只写计算式)。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是
(2)高温陶瓷材料Si3N4晶体中N-Si-N的键角大于Si-N-Si的键角,原因是
II.金属元素铁、铜及其化合物在日常生产、生活有着广泛的应用。
(1)铁在元素周期表中的位置
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(3)N2是CO的一种等电子体,两者相比较沸点较高的为
(4)铜晶体中铜原子的堆积方式如下图甲所示。
①基态铜原子的核外电子排布式为
② 每个铜原子周围距离最近的铜原子数目为
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如下图乙所示(黑点代表铜原子)。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】CuInSe2晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:
(1)硒(Se)是人体内必需的微量元素之一、基态Se原子的电子排布式为[Ar]___________ 。H2O、H2S和H2Se的沸点由低到高的顺序为___________ (填化学式,下同),还原性由弱到强的顺序为___________ ,键角由小到大的顺序为___________ 。SeF2分子存在角形和直线形两种异构体,其中直线形分子的键长较长,___________ 分子的能量较大。
(2)铟(In)为ⅢA族元素,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是___________ 。在乙醚中InCl3和LiH反应生成LiInH4,LiInH4中阴离子的空间结构为___________ 。
(3)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=a pm,c=c pm,α=β=γ=90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度ρ=___________ g·cm-3(用含有a、c、M和NA的代数式表示)。该晶胞中,原子坐标分别为1号Se原子___________ ,2号Cu原子(0,0.5,0.25),3号In原子(0,0.5,0.75)。晶体中有___________ 个Se原子距离4号Cu原子最近。

(1)硒(Se)是人体内必需的微量元素之一、基态Se原子的电子排布式为[Ar]
(2)铟(In)为ⅢA族元素,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是
(3)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=a pm,c=c pm,α=β=γ=90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】钛有“生物金属”和未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,则TiCl4属于
反应制得。TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,则TiCl4属于_______ 晶体。
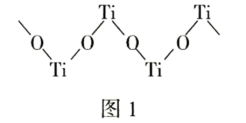
(2)硫酸氧钛晶体中阳离子为链状聚合形式的离子,部分结构如图1所示。该阳离子中Ti与O的原子个数之比为_______ ,其化学式为_______ 。
(3)钛与卤素形成的化合物的熔、沸点如表所示,分析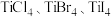 的熔点和沸点呈现一定规律的原因:
的熔点和沸点呈现一定规律的原因:_______ 。
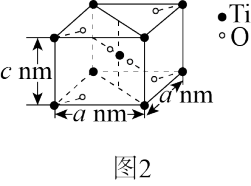
(4) 晶胞是典型的四方系结构,其结构如图2所示,晶胞参数为anm和cnm,设NA为阿伏加德罗常数的值,则该晶体的密度为
晶胞是典型的四方系结构,其结构如图2所示,晶胞参数为anm和cnm,设NA为阿伏加德罗常数的值,则该晶体的密度为_______ (写出表达式即可) 。
。
(1)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,则TiCl4属于
反应制得。TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,则TiCl4属于(2)硫酸氧钛晶体中阳离子为链状聚合形式的离子,部分结构如图1所示。该阳离子中Ti与O的原子个数之比为

(3)钛与卤素形成的化合物的熔、沸点如表所示,分析
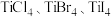 的熔点和沸点呈现一定规律的原因:
的熔点和沸点呈现一定规律的原因:| 熔点/℃ | 沸点/℃ | |
 | -25 | 136.5 |
 | 39 | 230 |
 | 150 | 377 |
 晶胞是典型的四方系结构,其结构如图2所示,晶胞参数为anm和cnm,设NA为阿伏加德罗常数的值,则该晶体的密度为
晶胞是典型的四方系结构,其结构如图2所示,晶胞参数为anm和cnm,设NA为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】硫及其化合物有许多用途,请回答下列问题。
(1)基态硫原子的价电子排布式为_______ ,其电子占据最高能级的电子云轮廓图形状为_______ ;
(2)炼铜原料黄铜矿中铜的主要存在形式是CuFeS2,煅烧黄铜矿生成SO2,SO2中心原子的价层电子对数为_______ ,其VSEPR模型为_______ ,请写出与SO2互为等电子体的一种阴离子_______ 。
(3)方铅矿(主要成分为PbS)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于_______ (填“极性”或“非极性”)分子,其中心原子的杂化方式为_______ 。下列分子的空间构型与H2S相同的有_______ ;
A.H2O B.CO2 C.SO2 D.CH4
(4)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点最高的是_______ ,原因是_______ 。
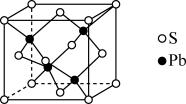
(5)PbS的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的正四面体空隙中。已知晶体密度为 g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为_______ nm。(已知PbS的摩尔质量为239g/mol)
(1)基态硫原子的价电子排布式为
(2)炼铜原料黄铜矿中铜的主要存在形式是CuFeS2,煅烧黄铜矿生成SO2,SO2中心原子的价层电子对数为
(3)方铅矿(主要成分为PbS)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于
A.H2O B.CO2 C.SO2 D.CH4
(4)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点最高的是
(5)PbS的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的正四面体空隙中。已知晶体密度为
 g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
您最近一年使用:0次



