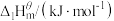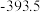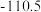碳、氮、硫及其化合物对生产、生活有重要的意义。
(1)以 与
与 为原料可合成尿素[
为原料可合成尿素[ ]。已知:
]。已知:
①
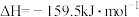
②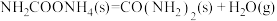
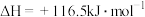
③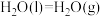
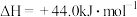
(1)写出 和
和 合成尿素和液态水的热化学方程式
合成尿素和液态水的热化学方程式___________ 。
(2)高温下, 与足量的碳在密闭容器中实现反应:
与足量的碳在密闭容器中实现反应: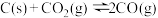 。向容积为1L的恒容容器中加入
。向容积为1L的恒容容器中加入
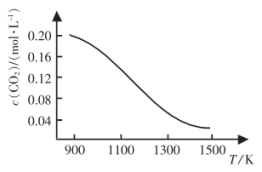
 和足量的碳,在不同温度下达到平衡时
和足量的碳,在不同温度下达到平衡时 的物质的量浓度随温度的变化如图所示。则该反应为
的物质的量浓度随温度的变化如图所示。则该反应为___________ (填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入
 ,达到新平衡后,体系中
,达到新平衡后,体系中 的百分含量
的百分含量___________ (填“变大”、“变小”或“不变”)。
(3) 与
与 能发生反应:
能发生反应: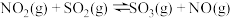
 在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率。部分实验结果如图所示:
的平衡转化率。部分实验结果如图所示:
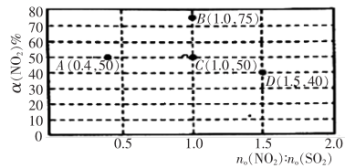
①当容器内___________ (填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强
B.气体的平均摩尔质量
C.气体的密度
D. 的体积分数
的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是___________ 。
③若A点对应实验中, (g)的起始浓度为
(g)的起始浓度为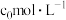 ,经过
,经过 达到平衡状态,该时段化学反应速率
达到平衡状态,该时段化学反应速率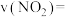
___________  。
。
④图中C、D两点对应的温度分别为 ℃和
℃和 ℃,通过计算判断
℃,通过计算判断
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(1)以
 与
与 为原料可合成尿素[
为原料可合成尿素[ ]。已知:
]。已知:①

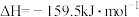
②
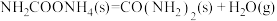
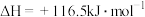
③
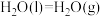
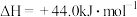
(1)写出
 和
和 合成尿素和液态水的热化学方程式
合成尿素和液态水的热化学方程式(2)高温下,
 与足量的碳在密闭容器中实现反应:
与足量的碳在密闭容器中实现反应: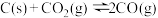 。向容积为1L的恒容容器中加入
。向容积为1L的恒容容器中加入
 和足量的碳,在不同温度下达到平衡时
和足量的碳,在不同温度下达到平衡时 的物质的量浓度随温度的变化如图所示。则该反应为
的物质的量浓度随温度的变化如图所示。则该反应为
 ,达到新平衡后,体系中
,达到新平衡后,体系中 的百分含量
的百分含量
(3)
 与
与 能发生反应:
能发生反应: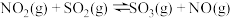
 在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率。部分实验结果如图所示:
的平衡转化率。部分实验结果如图所示:
①当容器内
A.气体的压强
B.气体的平均摩尔质量
C.气体的密度
D.
 的体积分数
的体积分数②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是
③若A点对应实验中,
 (g)的起始浓度为
(g)的起始浓度为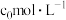 ,经过
,经过 达到平衡状态,该时段化学反应速率
达到平衡状态,该时段化学反应速率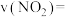
 。
。④图中C、D两点对应的温度分别为
 ℃和
℃和 ℃,通过计算判断
℃,通过计算判断
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
更新时间:2021-07-16 13:22:45
|
相似题推荐
【推荐1】碳和碳的化合物在生产、生活中有重要作用,乙烯、甲醇、甲酸等都是重要的能源物质。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
在相同条件下,起始反应最快的是_____ (填序号)。 的
的
_____ 。
(2)甲醇水蒸气重整,总反应为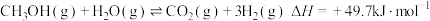 。
。
①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是_____ (填字母)。
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.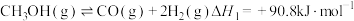
Ⅱ.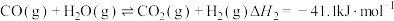
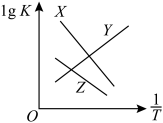
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是_____ ,理由是_____ 。
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:
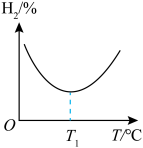
T1°C之后平衡体系中H2体积分数增大的原因是_____ 。
(3)CO2催化还原可以制备 和HCOOH:
和HCOOH:
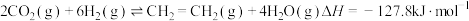 ;
;
 。
。
在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为_____ ,该温度下,甲酸化的平衡常数K=_____ (结果保留2位小数)。提示: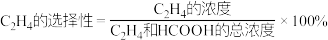
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
| 序号 | 化学反应 | E1/(kJ·mol-¹) | E2/(kJ·mol-¹) |
| ① | 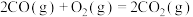 | 1954 | 2519 |
| ② | 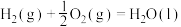 | 685 | 970 |
| ③ | 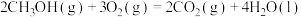 | 3526 | 4978 |
 的
的
(2)甲醇水蒸气重整,总反应为
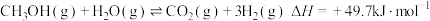 。
。①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.
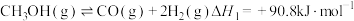
Ⅱ.
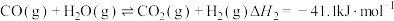
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与
 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:

T1°C之后平衡体系中H2体积分数增大的原因是
(3)CO2催化还原可以制备
 和HCOOH:
和HCOOH: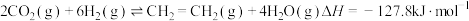 ;
; 。
。在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为
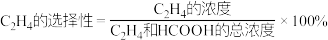
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】实现太阳能的转化与存储,近年来取得重大突破。利用含硫物质的热化学循环过程如图:
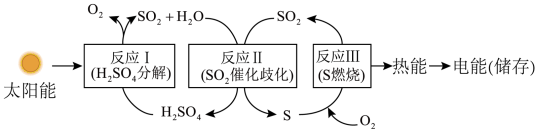
(1)反应Ⅰ由两步反应完成:
a.H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ·mol-1
b.2SO3(g)=2SO2(g)+H2O(g) △H2=+197kJ·mol-1
①反应Ⅰ的热化学方程式为____ 。
②对于反应Ⅰ中的b反应,如图纵坐标y表示SO3平衡转化率(%),横坐标x可表示温度或压强,A、B可表示温度曲线或压强曲线。则
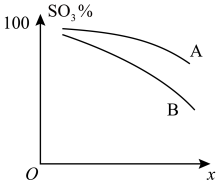
i.横坐标x可表示的物理量是____ 。
ii.当x的量一定时,A、B的大小关系是A____ B(填“<”“>”或“=”)。
(2)已知反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H3=-254kJ·mol-1
①在25℃时,该反应能否自发进行?____ (填“能”“否”或“不能确定”)。
②在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
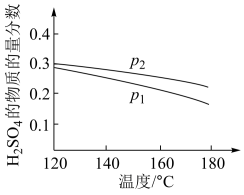
可得出结论p2>p1,其理由是____ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
A.SO2+4I-+4H+=S↓+2I2+2H2O
B.I2+2H2O+SO2=4H++SO +2I-
+2I-
欲探究A、B反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL。下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①b是a的对比实验,则n=____ 。
②比较a、b、c,可得出的结论是___ 。
③实验表明,SO2的歧化反应速率d>a,结合A、B反应速率解释原因:____ 。

(1)反应Ⅰ由两步反应完成:
a.H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ·mol-1
b.2SO3(g)=2SO2(g)+H2O(g) △H2=+197kJ·mol-1
①反应Ⅰ的热化学方程式为
②对于反应Ⅰ中的b反应,如图纵坐标y表示SO3平衡转化率(%),横坐标x可表示温度或压强,A、B可表示温度曲线或压强曲线。则

i.横坐标x可表示的物理量是
ii.当x的量一定时,A、B的大小关系是A
(2)已知反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H3=-254kJ·mol-1
①在25℃时,该反应能否自发进行?
②在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

可得出结论p2>p1,其理由是
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
A.SO2+4I-+4H+=S↓+2I2+2H2O
B.I2+2H2O+SO2=4H++SO
 +2I-
+2I-欲探究A、B反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL。下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 实验序号 | 试剂组成 | 实验现象 |
| a | 0.4mol·L-1KI | 溶液变黄,一段时间后出现浑浊 |
| b | nmol·L-1KI、0.2mol·L-1H2SO4 | 溶液变黄,出现浑浊较a快 |
| c | 0.2mol·L-1H2SO4 | 无明显现象 |
| d | 0.2mol·L-1KI、0.0002I2 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较a快 |
②比较a、b、c,可得出的结论是
③实验表明,SO2的歧化反应速率d>a,结合A、B反应速率解释原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石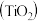 转化为
转化为 ,再进一步还原得到钛。回答下列问题:
,再进一步还原得到钛。回答下列问题:
(1) 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化: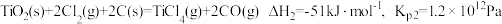
①反应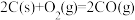 的
的 为
为_______  ,
,
_______ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______ 。
③对于碳氯化反应:增大压强,平衡_______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______ (填“变大”“变小”或“不变”)。
(2)在 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数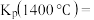
_______  。
。
②图中显示,在 平衡时
平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是_______ 。
(3) 碳氯化是一个“气—固—固”反应,有利于
碳氯化是一个“气—固—固”反应,有利于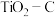 “固—固”接触的措施是
“固—固”接触的措施是_______ 。
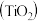 转化为
转化为 ,再进一步还原得到钛。回答下列问题:
,再进一步还原得到钛。回答下列问题:(1)
 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:

(ⅱ)碳氯化:
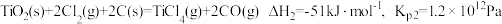
①反应
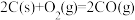 的
的 为
为 ,
,
②碳氯化的反应趋势远大于直接氯化,其原因是
③对于碳氯化反应:增大压强,平衡
(2)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。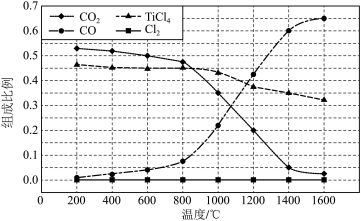
 的平衡常数
的平衡常数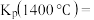
 。
。②图中显示,在
 平衡时
平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是(3)
 碳氯化是一个“气—固—固”反应,有利于
碳氯化是一个“气—固—固”反应,有利于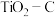 “固—固”接触的措施是
“固—固”接触的措施是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】保护生态环境、建设生态文明是历史发展的需要,研究NOx、CO等污染气体的处理具有重要意义。
I.目前,常利用催化技术将汽车尾气中的NO和CO转化成N2和CO2。
(1)已知;①N2(g) +O2(g) 2NO(g) ΔH1= +180.5 kJ·mol-1;
2NO(g) ΔH1= +180.5 kJ·mol-1;
②CO的摩尔燃烧焓ΔH2= -283.0 kJ·mol-1,则汽车尾气处理反应的热化学方程式为___________ 。
(2)某化学兴趣小组在三种不同实验条件下,向三个恒容密闭容器中,分别充入1molNO和lmolCO,发生上述反应,反应体系的总压强随时间变化情况如图所示:
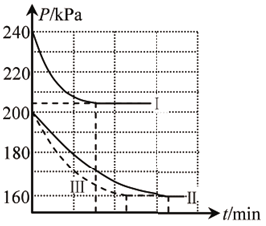
①曲线I对应的实验编号是___________ 。
②曲线III条件下,该反应的平衡常数Kp=___________ ( 用平衡分压代替平衡浓度计算,分压 =总压×物质的量分数)。
③若在曲线II对应条件下,NO、CO、N2、 CO2的分压依次是l0kPa、10kPa、 20kPa、10kPa,则此时反应速率: v(正)___________ v(逆)(填 “<”、“=” 或“>”)。
II.
(3)某温度下,实验测得反应NO2+CO=NO+CO2的速率方程为:v=kc2(NO2),其反应机理有如下两种可能。与其速率方程相符的反应机理是___________ (填编号)。
III.
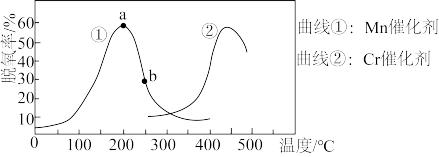
(4)若烟气中c (NO2):c(NO)=1:1, 用NH3催化还原法可以消除污染,发生的脱氮反应为: 2NH3(g) +NO(g) +NO2(g) 2N2 (g) +3H2O(g)。在不同温度下分别使用催化剂Mn和Cr时, 一定时间内的脱氮率如下图所示,由此可知工业上使用的最佳催化剂和相应最佳温度分别为
2N2 (g) +3H2O(g)。在不同温度下分别使用催化剂Mn和Cr时, 一定时间内的脱氮率如下图所示,由此可知工业上使用的最佳催化剂和相应最佳温度分别为___________ ;使用Mn作催化剂时,脱氮率a-b段呈现如图所示变化的原因可能是___________ 。
I.目前,常利用催化技术将汽车尾气中的NO和CO转化成N2和CO2。
(1)已知;①N2(g) +O2(g)
 2NO(g) ΔH1= +180.5 kJ·mol-1;
2NO(g) ΔH1= +180.5 kJ·mol-1;②CO的摩尔燃烧焓ΔH2= -283.0 kJ·mol-1,则汽车尾气处理反应的热化学方程式为
(2)某化学兴趣小组在三种不同实验条件下,向三个恒容密闭容器中,分别充入1molNO和lmolCO,发生上述反应,反应体系的总压强随时间变化情况如图所示:

| 实验编号 条件 | a | b | c |
| 温度/K | 500 | 500 | 600 |
| 催化剂的比表面积/m2·g-1 | 80.0 | 120 | 120 |
②曲线III条件下,该反应的平衡常数Kp=
③若在曲线II对应条件下,NO、CO、N2、 CO2的分压依次是l0kPa、10kPa、 20kPa、10kPa,则此时反应速率: v(正)
II.
(3)某温度下,实验测得反应NO2+CO=NO+CO2的速率方程为:v=kc2(NO2),其反应机理有如下两种可能。与其速率方程相符的反应机理是
| 反应机理 编号 | 第一步反应 | 第二步反应 |
| ① | 2NO2=N2O4 ( 快反应) | N2O4+2CO= 2NO+2CO2 ( 慢反应) |
| ② | 2NO2=NO3+NO (慢反应) | NO3+CO=NO2+CO2 ( 快反应) |
III.
(4)若烟气中c (NO2):c(NO)=1:1, 用NH3催化还原法可以消除污染,发生的脱氮反应为: 2NH3(g) +NO(g) +NO2(g)
 2N2 (g) +3H2O(g)。在不同温度下分别使用催化剂Mn和Cr时, 一定时间内的脱氮率如下图所示,由此可知工业上使用的最佳催化剂和相应最佳温度分别为
2N2 (g) +3H2O(g)。在不同温度下分别使用催化剂Mn和Cr时, 一定时间内的脱氮率如下图所示,由此可知工业上使用的最佳催化剂和相应最佳温度分别为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮氧化物是大气的主要污染物,为防治环境污染,科研人员做了大量研究。
I.汽油燃油车上安装三元催化转化器,可以使 和
和 两种尾气反应生成
两种尾气反应生成 ,可有效降低汽车尾气污染,反应为
,可有效降低汽车尾气污染,反应为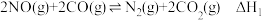 。
。
(1)下表中数据是该反应中的相关物质的标准摩尔生成焓(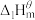 )(标准摩尔生成焓是指在
)(标准摩尔生成焓是指在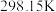 、
、 条件下,由稳定态单质生成
条件下,由稳定态单质生成 化合物时的焓变)数据。
化合物时的焓变)数据。
则
__________  。
。
(2)将 和
和 按物质的量之比
按物质的量之比 以一定的流速分别通过两种催化剂(
以一定的流速分别通过两种催化剂(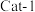 和
和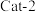 )进行反应,相同时间内测定逸出气体中
)进行反应,相同时间内测定逸出气体中 的含量,从而确定尾气脱氮率(
的含量,从而确定尾气脱氮率( 的转化率),结果如图所示。
的转化率),结果如图所示。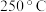 下脱氮率较高的催化剂是
下脱氮率较高的催化剂是__________ (填“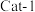 ”或“
”或“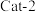 ”)。
”)。
②催化剂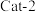 催化条件下,
催化条件下,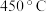 后,脱氮率随温度升高而下降的原因是
后,脱氮率随温度升高而下降的原因是_______________ 。
Ⅱ.一定条件下 与
与 可发生反应:
可发生反应: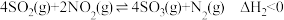 。
。
(3)将 与
与 按物质的量之比
按物质的量之比 置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
(4)将一定量的 与
与 置于密闭容器中发生反应,在相同时间内测得
置于密闭容器中发生反应,在相同时间内测得 的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。 的平衡转化率与压强、温度及氮硫比
的平衡转化率与压强、温度及氮硫比 的关系如图2所示。
的关系如图2所示。_______________ 。
②图2中压强:
__________ (填“>”“<”或“=”,下同) ,氮硫比:
,氮硫比:
__________  。
。
③温度为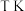 ,压强恒定为
,压强恒定为 时,反应平衡常数
时,反应平衡常数
__________ 。
I.汽油燃油车上安装三元催化转化器,可以使
 和
和 两种尾气反应生成
两种尾气反应生成 ,可有效降低汽车尾气污染,反应为
,可有效降低汽车尾气污染,反应为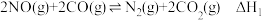 。
。(1)下表中数据是该反应中的相关物质的标准摩尔生成焓(
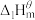 )(标准摩尔生成焓是指在
)(标准摩尔生成焓是指在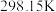 、
、 条件下,由稳定态单质生成
条件下,由稳定态单质生成 化合物时的焓变)数据。
化合物时的焓变)数据。物质 |
|
|
|
|
| 0 |
|
| 90 |

 。
。(2)将
 和
和 按物质的量之比
按物质的量之比 以一定的流速分别通过两种催化剂(
以一定的流速分别通过两种催化剂( 和
和 )进行反应,相同时间内测定逸出气体中
)进行反应,相同时间内测定逸出气体中 的含量,从而确定尾气脱氮率(
的含量,从而确定尾气脱氮率( 的转化率),结果如图所示。
的转化率),结果如图所示。
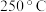 下脱氮率较高的催化剂是
下脱氮率较高的催化剂是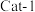 ”或“
”或“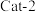 ”)。
”)。②催化剂
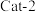 催化条件下,
催化条件下,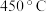 后,脱氮率随温度升高而下降的原因是
后,脱氮率随温度升高而下降的原因是Ⅱ.一定条件下
 与
与 可发生反应:
可发生反应: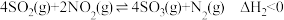 。
。(3)将
 与
与 按物质的量之比
按物质的量之比 置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。| A.体系压强保持不变 | B. 与 与 的物质的量之比保持不变 的物质的量之比保持不变 |
C. | D.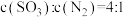 |
(4)将一定量的
 与
与 置于密闭容器中发生反应,在相同时间内测得
置于密闭容器中发生反应,在相同时间内测得 的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。 的平衡转化率与压强、温度及氮硫比
的平衡转化率与压强、温度及氮硫比 的关系如图2所示。
的关系如图2所示。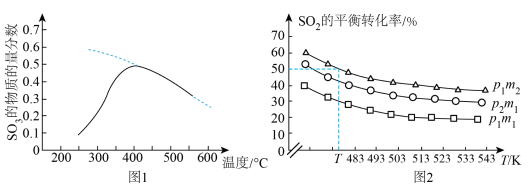
②图2中压强:

 ,氮硫比:
,氮硫比:
 。
。③温度为
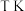 ,压强恒定为
,压强恒定为 时,反应平衡常数
时,反应平衡常数
您最近一年使用:0次
【推荐3】2019年诺贝尔化学奖授予对锂离子电池研究作出贡献的三位科学家。
(1)最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是_______ ,属于活泼金属,使电池存在较大安全隐患。
(2)现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂电池的工作原理如图所示:
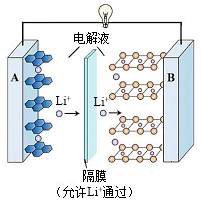
该电池放电时,其中一极的电极反应式是 ,则该极应为图中的
,则该极应为图中的__ (填“A”或“B”)。
(3)天然气的主要成分为 ,一般还含有
,一般还含有 等烃类,是重要的燃料和化工原料,乙烷在一定条件可发生如下反应:
等烃类,是重要的燃料和化工原料,乙烷在一定条件可发生如下反应: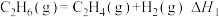 ,相关物质的燃烧热数据如下表所示:
,相关物质的燃烧热数据如下表所示:
①
_______  。
。
②提高该反应平衡转化率的方法有_______ 、_______ 。
③容器中通入等物质的量的乙烷和氢气,在等压下 发生上述反应,乙烷的平衡转化率为α。反应的平衡常数
发生上述反应,乙烷的平衡转化率为α。反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
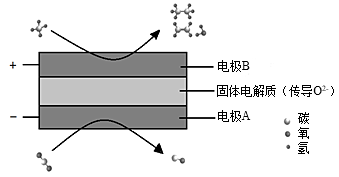
①阴极上的反应式为_______ 。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的 和
和 体积比为
体积比为_______ 。
(1)最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是
(2)现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂电池的工作原理如图所示:

该电池放电时,其中一极的电极反应式是
 ,则该极应为图中的
,则该极应为图中的(3)天然气的主要成分为
 ,一般还含有
,一般还含有 等烃类,是重要的燃料和化工原料,乙烷在一定条件可发生如下反应:
等烃类,是重要的燃料和化工原料,乙烷在一定条件可发生如下反应: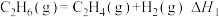 ,相关物质的燃烧热数据如下表所示:
,相关物质的燃烧热数据如下表所示:| 物质 | 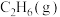 | 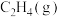 |  |
燃烧热 | -1560 | -1411 | -286 |
①

 。
。②提高该反应平衡转化率的方法有
③容器中通入等物质的量的乙烷和氢气,在等压下
 发生上述反应,乙烷的平衡转化率为α。反应的平衡常数
发生上述反应,乙烷的平衡转化率为α。反应的平衡常数
(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的
 和
和 体积比为
体积比为
您最近一年使用:0次