重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
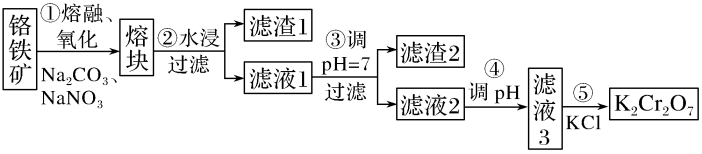
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2↑+NaNO2
Na2CrO4+Fe2O3+CO2↑+NaNO2
分析回答下列问题:
①上述反应中的还原产物是____ ,处理含1molFeO·Cr2O3的铬铁矿,转移电子数为____ NA。
②氧化铝和二氧化硅一样能和纯碱在高温条件反应生成二氧化碳,下列不能作为熔融铬铁矿容器的是_______ (填字母)。
a.石英坩埚 b.氧化铝陶瓷坩埚 c.普通陶瓷坩埚 d.白金坩埚
(2)滤渣1中含量最多的金属元素是____ ,滤渣2的主要成分是_____ 及含硅杂质。
(3)步骤④调滤液2的pH使之变____ (填“大”或“小”),原因是_____ (用离子方程式表示)。
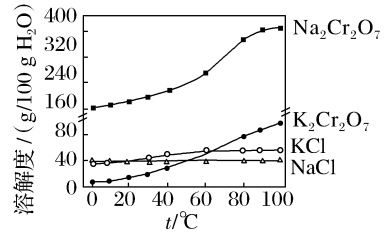
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到_____ (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是_____ 。

(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2↑+NaNO2
Na2CrO4+Fe2O3+CO2↑+NaNO2分析回答下列问题:
①上述反应中的还原产物是
②氧化铝和二氧化硅一样能和纯碱在高温条件反应生成二氧化碳,下列不能作为熔融铬铁矿容器的是
a.石英坩埚 b.氧化铝陶瓷坩埚 c.普通陶瓷坩埚 d.白金坩埚
(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到
a.80℃ b.60℃ c.40℃ d.10℃

步骤⑤的反应类型是
2021高三·全国·专题练习 查看更多[3]
(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)
更新时间:2021-08-10 14:05:39
|
相似题推荐
【推荐1】焦亚硫酸钠(Na2S2O5)是葡萄酒中常用的抗氧化剂。以硫黄为原料的传统湿法生产工艺流程如下:

已知:NaHSO3的过饱和溶液经结晶脱水可生成Na2S2O5。
回答下列问题:
(1)为便于焚烧,可对硫黄采取的措施是__________________ 。
(2)废水中含有硫单质,其中一种分子组成为S8,可与KOH溶液发生如下反应:3S8+48KOH 16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比为
16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比为_________ 。
(3)反应器中发生反应的离子方程式为__________________ 。
(4)Na2S2O5是强还原剂,很容易被O2氧化,同时放出一种有刺激性气味的气体,该反应的化学方程式为__________________ 。
(5)Na2S2O5生产过程中会产生SO2,SO2在空气中的含量超过0.02 mg·L-1就会危害人类健康。可用如下装置测定空气中SO2的含量。
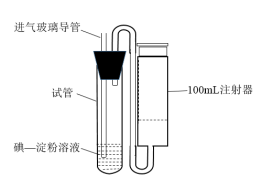
①取5 mL 5×10-4 mol·L-1的碘溶液E入试管中,再加入2~3滴淀粉溶液,在测定地点慢慢抽气,每次抽气100 mL,直到试管中的溶液_________ (填写现象)。
②记录抽气次数n。n≥_________ ,说明气体符合安全标准(假设气体均处于标准状况)。
③抽气时应慢慢抽拉活塞,原因是__________________ 。

已知:NaHSO3的过饱和溶液经结晶脱水可生成Na2S2O5。
回答下列问题:
(1)为便于焚烧,可对硫黄采取的措施是
(2)废水中含有硫单质,其中一种分子组成为S8,可与KOH溶液发生如下反应:3S8+48KOH
 16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比为
16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比为(3)反应器中发生反应的离子方程式为
(4)Na2S2O5是强还原剂,很容易被O2氧化,同时放出一种有刺激性气味的气体,该反应的化学方程式为
(5)Na2S2O5生产过程中会产生SO2,SO2在空气中的含量超过0.02 mg·L-1就会危害人类健康。可用如下装置测定空气中SO2的含量。

①取5 mL 5×10-4 mol·L-1的碘溶液E入试管中,再加入2~3滴淀粉溶液,在测定地点慢慢抽气,每次抽气100 mL,直到试管中的溶液
②记录抽气次数n。n≥
③抽气时应慢慢抽拉活塞,原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】化学源于生活,下列物质为生活中常见的日用品,括号内为对应物品的主要成分或有效成分。
①食盐(NaCl) ②食醋(醋酸) ③碱面( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是__________ (填序号)。
(2)若要鉴别某白色固体是食盐还是碱面,可以用____________ (填序号)来鉴别,若白色固体是碱面,观察到的现象是___________________________ 。
(3)酸性 和
和 会发生如下反应:
会发生如下反应:
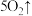 ,该反应的氧化产物为
,该反应的氧化产物为_________ ,若反应过程中转移2mol  ,参与反应的
,参与反应的 的物质的量为
的物质的量为____________ 。
(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:____________________ ;84消毒液能与 反应生成具有漂白作用的HClO,该反应的化学方程式为
反应生成具有漂白作用的HClO,该反应的化学方程式为____________________ 。
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:___________________________________________ 。
①食盐(NaCl) ②食醋(醋酸) ③碱面(
 ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是
(2)若要鉴别某白色固体是食盐还是碱面,可以用
(3)酸性
 和
和 会发生如下反应:
会发生如下反应:
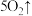 ,该反应的氧化产物为
,该反应的氧化产物为 ,参与反应的
,参与反应的 的物质的量为
的物质的量为(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:
 反应生成具有漂白作用的HClO,该反应的化学方程式为
反应生成具有漂白作用的HClO,该反应的化学方程式为(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高铁酸钾(K2FeO4)具有强氧化性,是一种环保、高效、多功能的饮用水处理剂,可用如下流程进行制备。请回答下列问题:

(1) K2FeO4中铁元素的化合价是___________ 。
(2)“氧化”过程中,生成Fe3+的离子方程式为___________
(3)“制备Na2FeO4”中还原剂和氧化剂的物质的量之比为___________ 。
(4)“转化”中析出K2FeO4晶体的原因可能是___________ 。
(5) K2FeO4溶于水后,会缓慢放出气体,并杀菌消毒,同时还能达到净水目的。请结合有关离子方程式解释K2FeO4杀菌、净水的原理___________ 。
(6)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:

①反应中被氧化的Na2O2与被FeSO4还原的Na2O2的物质的量比为1:4,请写出该反应配平后的方程式___________ 。
②若反应产生16.8L(标准状况)O2,则转移的电子为___________ mol。

(1) K2FeO4中铁元素的化合价是
(2)“氧化”过程中,生成Fe3+的离子方程式为
(3)“制备Na2FeO4”中还原剂和氧化剂的物质的量之比为
(4)“转化”中析出K2FeO4晶体的原因可能是
(5) K2FeO4溶于水后,会缓慢放出气体,并杀菌消毒,同时还能达到净水目的。请结合有关离子方程式解释K2FeO4杀菌、净水的原理
(6)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:

①反应中被氧化的Na2O2与被FeSO4还原的Na2O2的物质的量比为1:4,请写出该反应配平后的方程式
②若反应产生16.8L(标准状况)O2,则转移的电子为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铝氢化钠(NaAlH4)是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝氢化钠的一种工艺流程如下:
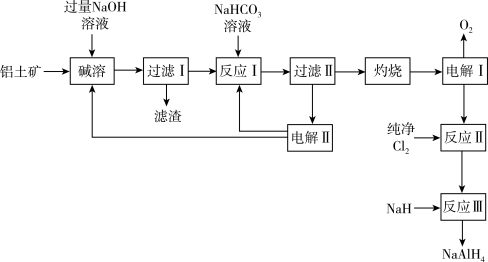
注意:SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2Si2O8)沉淀。
(1)提高“碱溶”浸出率的措施为_______ (任写一条)。
(2)铝硅酸钠(Na2Al2Si2O8)可以用氧化物的形式表示其组成,形式为_______ 。
(3)向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______ 、_______ 。
(4)“反应III”的化学方程式_______ 。

注意:SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2Si2O8)沉淀。
(1)提高“碱溶”浸出率的措施为
(2)铝硅酸钠(Na2Al2Si2O8)可以用氧化物的形式表示其组成,形式为
(3)向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为
(4)“反应III”的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】重铬酸钾是一种重要的强氧化剂,工业上常用铬铁矿(主要成分是亚铬酸亚铁Fe(CrO2)2,还有硅、铝等杂质)为主要原料生产重铬酸钾(K2Cr2O7),主要工艺流程如图:

(1)步骤①中主要反应的化学方程式___ 。
(2)步骤③中沉淀是___ (填化学式)
(3)步骤④中反应的离子方程式为___ 。
(4)有关物质的溶解度如图所示。
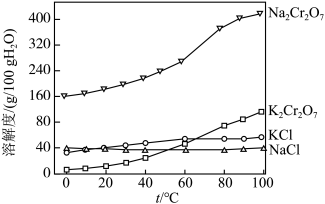
步骤⑤加氯化钾固体后的具体实验操作为___ 。经洗涤、干燥得到K2Cr2O7晶体样品,得到的样品中含有少量的NaCl等杂质,洗涤晶体适宜选用的试剂为___ 。
a.冷水 b.75%乙醇 c.四氯化碳
(5)向一支试管中加入H2O2溶液、乙醚、稀硫酸溶液和几滴K2Cr2O7溶液,经反应后发现上层为蓝色的CrO5乙醚溶液。CrO5中铬的化合价为+6价,求-2价和-1价氧的个数比为___ ,一段时间后,蓝色逐渐消失,其反应的离子方程式为4CrO5+12H+=4Cr3++7O2↑+6H2O,消耗1mol的CrO5转移电子的物质的量为___ mol。

(1)步骤①中主要反应的化学方程式
(2)步骤③中沉淀是
(3)步骤④中反应的离子方程式为
(4)有关物质的溶解度如图所示。

步骤⑤加氯化钾固体后的具体实验操作为
a.冷水 b.75%乙醇 c.四氯化碳
(5)向一支试管中加入H2O2溶液、乙醚、稀硫酸溶液和几滴K2Cr2O7溶液,经反应后发现上层为蓝色的CrO5乙醚溶液。CrO5中铬的化合价为+6价,求-2价和-1价氧的个数比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
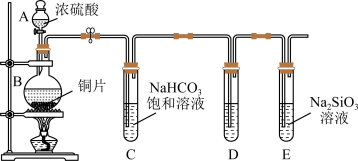
【推荐3】为了探究硫、碳、硅元素的非金属性的相对强弱,某实验小组设计了如图装置。_______ 。
(2)实验步骤:连接仪器、_______ 、加药品后、打开a、滴入浓硫酸、加热。
(3)问题探究
①装置D中足量酸性 溶液的作用是
溶液的作用是_______ 。
②实验装置E中有白色沉淀生成,_______ (填“能”或“不能”)作为判断碳元素的非金属性比硅元素非金属性强的依据,请说明理由:_______ 。
③写出铜与浓硫酸反应的化学方程式:_______ 。
(4)设计实验比较 和
和 的氧化性,操作与现象是取少量新制氯水和
的氧化性,操作与现象是取少量新制氯水和 于试管中,
于试管中,_______ 。
(2)实验步骤:连接仪器、
(3)问题探究
①装置D中足量酸性
 溶液的作用是
溶液的作用是②实验装置E中有白色沉淀生成,
③写出铜与浓硫酸反应的化学方程式:
(4)设计实验比较
 和
和 的氧化性,操作与现象是取少量新制氯水和
的氧化性,操作与现象是取少量新制氯水和 于试管中,
于试管中,
您最近一年使用:0次
【推荐1】硫酸锰是重要的微量元素肥料之一,易溶于水,难溶于乙醇。工业上用软锰矿(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)通过如下简化流程既可脱除燃煤尾气中的SO2,又能制备硫酸锰晶体,实现了资源的综合利用:
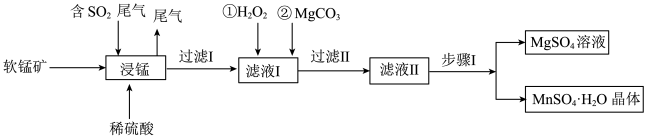
请回答下列问题:
(1)上述流程中第一步浸锰脱硫的好处是_________ (答出一点即可)。
(2)写出浸锰过程中软锰矿中的MnO2发生的化学方程式_________ 。
(3)通过实验如何判定滤液Ⅰ中已加入足量H2O2__________ ;加MnCO3的目的是调节溶液的pH,使滤液Ⅰ中的相关离子形成沉淀而除去,请写出 “过滤 Ⅱ”中所得滤渣的主要成分有________ 。
(4)已知硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
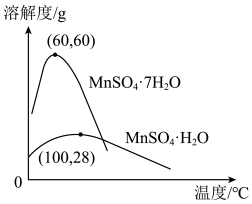
请写出步骤Ⅰ操作_________ 、趁热过滤;为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的________ (填选项字母)进行洗涤,实验效果最佳。
A 乙醇 B 饱和K2SO4溶液 C 蒸馏水 D 乙醇水溶液
(5)滤液Ⅱ还可通过加入过量NH4HCO3进行“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_________ 。“50℃碳化”可能的原因是:_________ 。

请回答下列问题:
(1)上述流程中第一步浸锰脱硫的好处是
(2)写出浸锰过程中软锰矿中的MnO2发生的化学方程式
(3)通过实验如何判定滤液Ⅰ中已加入足量H2O2
(4)已知硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。

请写出步骤Ⅰ操作
A 乙醇 B 饱和K2SO4溶液 C 蒸馏水 D 乙醇水溶液
(5)滤液Ⅱ还可通过加入过量NH4HCO3进行“50℃碳化”得到高纯碳酸锰,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】二硫化钨(WS2,其中W的化合价为+4)可用作润滑剂,还可以在石油化工领域中用作催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如图所示:
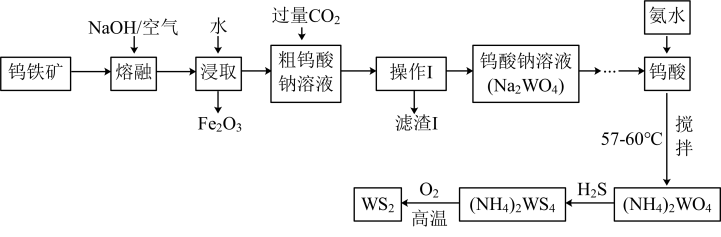
回答下列问题:
(1)FeWO4中铁元素的化合价为________ 。
(2)FeWO4在“熔融”过程中发生反应的化学方程式为________ ;“熔融”过程中为了提高熔融速率,可采取的措施有_______ (写出一条即可)。
(3)过量CO2通入粗钨酸钠溶液中发生反应的离子方程式为________ ,操作Ⅰ中用作引流的玻璃仪器是________ 。
(4)生成二硫化钨的化学方程式为2(NH4)2WS4+3O2 2WS2+4NH3+2S+2SO2+2H2O,若反应中转移8 mol电子,则生成WS2的质量是
2WS2+4NH3+2S+2SO2+2H2O,若反应中转移8 mol电子,则生成WS2的质量是________ g。

回答下列问题:
(1)FeWO4中铁元素的化合价为
(2)FeWO4在“熔融”过程中发生反应的化学方程式为
(3)过量CO2通入粗钨酸钠溶液中发生反应的离子方程式为
(4)生成二硫化钨的化学方程式为2(NH4)2WS4+3O2
 2WS2+4NH3+2S+2SO2+2H2O,若反应中转移8 mol电子,则生成WS2的质量是
2WS2+4NH3+2S+2SO2+2H2O,若反应中转移8 mol电子,则生成WS2的质量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质) 为原料冶炼铝的工艺流程如下:
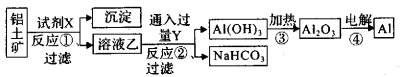
回答下列问题:
(1)上述反应,其中是氧化还原反应的有___ 个;写出试剂X的化学式___ 。
(2)反应②的离子反应方程式______________ 。
(3)反应①后过滤的沉淀为_____ ,简述确定此物质中金属元素及其价态的操作过程____ 。
(4)反应①后过滤时必须用到的玻璃仪器有______________ 。
(5)请你写出检验试剂X中含有阳离子的实验操作:______________ 。

回答下列问题:
(1)上述反应,其中是氧化还原反应的有
(2)反应②的离子反应方程式
(3)反应①后过滤的沉淀为
(4)反应①后过滤时必须用到的玻璃仪器有
(5)请你写出检验试剂X中含有阳离子的实验操作:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________ 。
(2)操作Ⅰ的目的是_______________________ 和调节溶液的PH 至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________ 。
(3)通过煅烧MnSO4·H2O 可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x 的值为______________ 。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________


已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、
(2)操作Ⅰ的目的是
(3)通过煅烧MnSO4·H2O 可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x 的值为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分是氧化锌和金属锌,杂质为PbO、FeO、Fe3O4、Cu等。利用锌灰生产皓矾(ZnSO4·7H2O)和ZnO等化工产品的工艺流程之一如下:
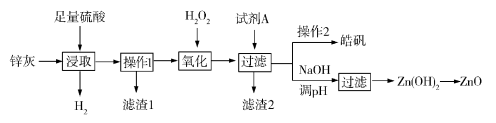
已知pH>11.5时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2−。下表列出了几种离子生成氢氧化物沉淀的 pH:
请回答下列问题:
(1)“滤渣1”的主要成分是___________ 。
(2)加入过量H2O2的目的是___________ (结合离子方程式回答),除去剩余H2O2的简便方法是___________ 。
(3)“试剂A”最好是下列物质中的___________ 。
A.ZnO B.Zn C.NaOH D.ZnCO3
(4)“操作2”包括蒸发浓缩、___________ 、过滤洗涤。
(5)加NaOH调pH时,应该控制的pH范围是___________ 。

已知pH>11.5时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2−。下表列出了几种离子生成氢氧化物沉淀的 pH:
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.5 | 3.2 |
| Fe2+ | 6.5 | 9.0 |
| Zn2+ | 5.6 | 8.1 |
| Pb2+ | 6.6 | 9.1 |
请回答下列问题:
(1)“滤渣1”的主要成分是
(2)加入过量H2O2的目的是
(3)“试剂A”最好是下列物质中的
A.ZnO B.Zn C.NaOH D.ZnCO3
(4)“操作2”包括蒸发浓缩、
(5)加NaOH调pH时,应该控制的pH范围是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
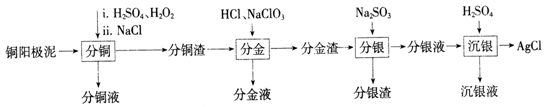
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3- Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________ ;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______ 。
②已知“分铜”时 各元素的浸出率如下表所示。
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________ 。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: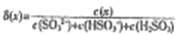 ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
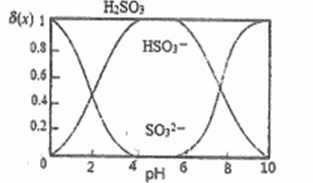
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____ (用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________ 。 (忽略溶液体积变化)

已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-
 Ag++2SO32-。
Ag++2SO32-。(1)①“分铜”时,单质铜发生反应的化学方程式为
②已知“分铜”时 各元素的浸出率如下表所示。
| Cu | Au | Ag | |
| 浸出率/% | 85.7 | 0 | 4.5 |
(2)“分金”时,单质金发生反应的离子方程式为
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知:
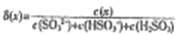 ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
①分析能够析出AgCl的原因为
②调节溶液的PH不能过低,理由为
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为
您最近一年使用:0次



