利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
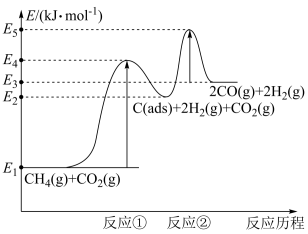
CH4与CO2制备合成气的热化学方程式为__ 。
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
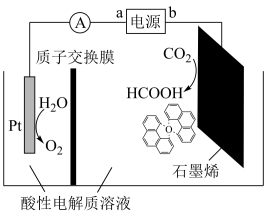
①电池工作过程中,图中Pt电极附近溶液的pH__ (填“变大”或“变小”),阴极的电极反应式为___ 。
②每转移2mol电子,阴极室溶液质量增加___ g。
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
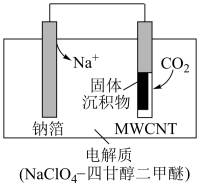
①放电时,正极的电极反应式为___ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为___ g。(假设放电前两电极质量相等)
①CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2③CO2(g)+H2(g)
 CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH
②每转移2mol电子,阴极室溶液质量增加
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为
更新时间:2021-10-18 17:03:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】已知 可以独立或与氮的化合物协同舒张血管平滑肌,同时还起人体重要生理调节功能。
可以独立或与氮的化合物协同舒张血管平滑肌,同时还起人体重要生理调节功能。
(1)已知: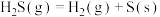

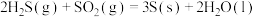
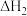
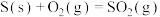

利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应(填写化学方程式)的 。
。
(2)NiFeV催化剂能在温和条件下实现固氮,其催化机理如图。
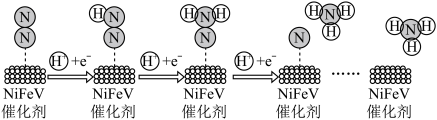
该反应总方程式为_______ 。
(3)有人设想将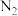 、
、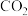 与
与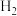 用电解的方法实现下列转化,其原理如图。
用电解的方法实现下列转化,其原理如图。
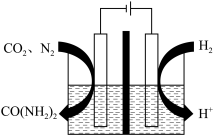
该装置中所选交换膜为_______ (填“阳离子”或“阴离子”)交换膜。请你对该设计的优缺点进行评价:_______ 。
(4)芬顿反应原理是高级氧化水中含氮化合物技术的经典工艺之一,如图所示( 和
和 为速率常数)
为速率常数)
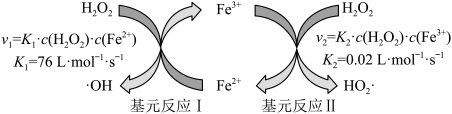 。
。
相同条件下,基元反应I的活化能_______ (填:大于、小于、等于、无法确定)基元反应II的活化能。解释上述反应进行后,初始阶段反应体系中溶液的酸碱性变化及原因_______ 。
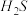 可以独立或与氮的化合物协同舒张血管平滑肌,同时还起人体重要生理调节功能。
可以独立或与氮的化合物协同舒张血管平滑肌,同时还起人体重要生理调节功能。(1)已知:
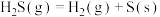

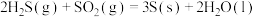
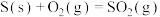

利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(2)NiFeV催化剂能在温和条件下实现固氮,其催化机理如图。

该反应总方程式为
(3)有人设想将
 、
、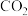 与
与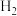 用电解的方法实现下列转化,其原理如图。
用电解的方法实现下列转化,其原理如图。
该装置中所选交换膜为
(4)芬顿反应原理是高级氧化水中含氮化合物技术的经典工艺之一,如图所示(
 和
和 为速率常数)
为速率常数) 。
。 相同条件下,基元反应I的活化能
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】原理综合题
汽车尾气中含有 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
Ⅰ.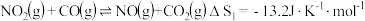
Ⅱ.
Ⅲ.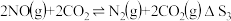
(1)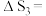
______  忽略
忽略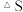 受温度的影响
受温度的影响 。
。
(2)反应Ⅰ的平衡常数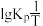 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为______  填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为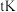 时,
时,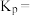
______ ,向恒容密闭容器中加入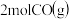 和
和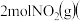 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为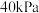 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为______ , 的平衡分压为
的平衡分压为______ 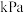 。
。
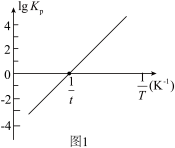
(3)将等物质的量的 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:______ 。
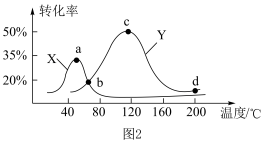
(4)间接电解法可对大气污染物 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
①电极 的电极反应式为
的电极反应式为______ 。
②工作时有 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为______  。
。
汽车尾气中含有
 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:Ⅰ.
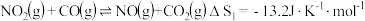
Ⅱ.

Ⅲ.
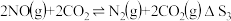
(1)
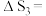
 忽略
忽略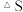 受温度的影响
受温度的影响 。
。(2)反应Ⅰ的平衡常数
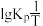 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为 填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为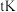 时,
时,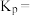
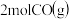 和
和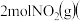 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为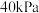 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的平衡分压为
的平衡分压为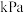 。
。
(3)将等物质的量的
 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:
(4)间接电解法可对大气污染物
 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
①电极
 的电极反应式为
的电极反应式为②工作时有
 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中NO(g)和CO(g)反应生成无毒的 和
和 。
。
(1)已知:
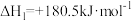
CO的燃烧热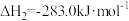
则

_______  。
。
(2)实验测得,反应 的
的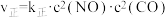 ,
,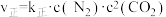 。(
。( 、
、 为速率常数,只与温度有关)
为速率常数,只与温度有关)
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“>”、“<”或“=”)  增大的倍数。
增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,一定温度下达到平衡时,CO的转化率为40%,则
_______ (精确到0.1)。
(3)化学研究小组在三个容积为5 L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,发生反应 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
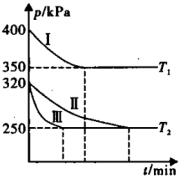
①温度:T1_______ T2(填“<”、“=”或“>”,下同)。
②CO的平衡转化率:Ⅰ_______ Ⅱ_______ Ⅲ。
③T2时的平衡常数
_______ (列出计算式即可)。
(4)碘蒸气存在能大幅度提高 的分解速率,反应历程为:
的分解速率,反应历程为:
第一步: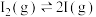 (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程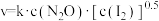 (k为速率常数)。下列表述正确的是_______(填字母)。
(k为速率常数)。下列表述正确的是_______(填字母)。
 和
和 。
。(1)已知:

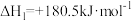
CO的燃烧热
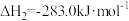
则


 。
。(2)实验测得,反应
 的
的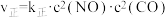 ,
,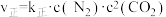 。(
。( 、
、 为速率常数,只与温度有关)
为速率常数,只与温度有关)①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②若在2 L的密闭容器中充入1 mol CO和1 mol NO,一定温度下达到平衡时,CO的转化率为40%,则

(3)化学研究小组在三个容积为5 L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,发生反应
 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
①温度:T1
②CO的平衡转化率:Ⅰ
③T2时的平衡常数

(4)碘蒸气存在能大幅度提高
 的分解速率,反应历程为:
的分解速率,反应历程为:第一步:
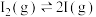 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程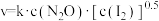 (k为速率常数)。下列表述正确的是_______(填字母)。
(k为速率常数)。下列表述正确的是_______(填字母)。A. 分解反应速率与是否含碘蒸气无关 分解反应速率与是否含碘蒸气无关 |
| B.第二步对总反应速率起决定作用 |
| C.第二步活化能最小 |
| D.IO为反应的催化剂 |
您最近一年使用:0次
【推荐1】完成下列问题。
(1)已知:①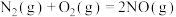
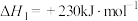
②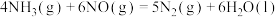
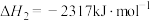
则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(2)已知几种化学键的键能和热化学方程式如下:

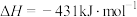 ,则
,则 =
=___________ 。
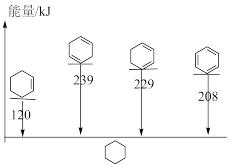
(3)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(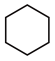 )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应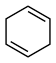 (l)=
(l)=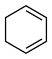 (l)的
(l)的 =
=___________ 。
(4)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:___________ ,若两个最近的 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是___________  。
。

(1)已知:①
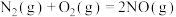
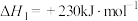
②
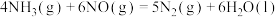
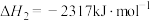
则表示氨气燃烧热的热化学方程式为
(2)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 |  | 432 |

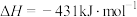 ,则
,则 =
=(3)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应 (l)=
(l)= (l)的
(l)的 =
=
(4)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能、高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应为:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g) = CO2(g) Ⅴ.CaCO3(s) = CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=__ (用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是___ 。
A.混合气体的体积不再变化
B.H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化
D.形成amolH—H键的同时断裂2amolH—O键
(2)已知反应Ⅱ(CO(g)+H2O(g) CO2(g)+H2(g) 的ΔH=-41.1kJ·mol−1,C=O、O—H、H—H的键能分别为803kJ·mol−1,464kJ·mol−1、436kJ·mol−1,则CO中碳氧键的键能为
CO2(g)+H2(g) 的ΔH=-41.1kJ·mol−1,C=O、O—H、H—H的键能分别为803kJ·mol−1,464kJ·mol−1、436kJ·mol−1,则CO中碳氧键的键能为___ kJ·mol−1。
(3)对于反应Ⅲ,[CaO(s)+CO2(g) CaCO3(s)]若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为
CaCO3(s)]若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为______ ;当重新平衡后,CO2浓度________ (填“变大”“变小”或“不变”)。
(4)实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
①已知某反应的平衡表达式为:K=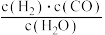 ,它所对应的化学方程式为:
,它所对应的化学方程式为:_________ 。
②已知在400℃时,N2(g)+3H2(g) 2NH3(g) △H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正
2NH3(g) △H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正________ υ(N2)逆(填:>、<、=、不能确定)。欲使该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是_________ (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
Ⅰ.C(s)+H2O(g)
 CO(g)+H2(g) K1;
CO(g)+H2(g) K1;Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;Ⅲ.CaO(s)+CO2(g)
 CaCO3(s) K3;
CaCO3(s) K3;燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g) = CO2(g) Ⅴ.CaCO3(s) = CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=A.混合气体的体积不再变化
B.H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化
D.形成amolH—H键的同时断裂2amolH—O键
(2)已知反应Ⅱ(CO(g)+H2O(g)
 CO2(g)+H2(g) 的ΔH=-41.1kJ·mol−1,C=O、O—H、H—H的键能分别为803kJ·mol−1,464kJ·mol−1、436kJ·mol−1,则CO中碳氧键的键能为
CO2(g)+H2(g) 的ΔH=-41.1kJ·mol−1,C=O、O—H、H—H的键能分别为803kJ·mol−1,464kJ·mol−1、436kJ·mol−1,则CO中碳氧键的键能为(3)对于反应Ⅲ,[CaO(s)+CO2(g)
 CaCO3(s)]若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为
CaCO3(s)]若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为(4)实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
①已知某反应的平衡表达式为:K=
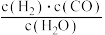 ,它所对应的化学方程式为:
,它所对应的化学方程式为:②已知在400℃时,N2(g)+3H2(g)
 2NH3(g) △H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正
2NH3(g) △H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g) CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
则x=__________________ 。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g) ∆H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
CH3OH(g) ∆H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
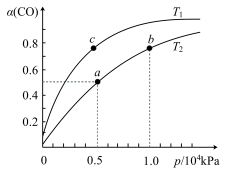
①a、b两点的反应速率:v(a)______ v(b)(填“>”、“<”、“=”)
②T1______ T2(填“>”、“<”、“=”),原因是_________________________ 。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是________ (填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)已知反应CO(g)+2H2(g)
 CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | x | 465 | 413 |
则x=
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g) ∆H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
CH3OH(g) ∆H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(a)
②T1
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】CO2的转化和利用是实现碳中和的有效途径。回答下列问题。
I.利用CO2合成淀粉涉及的关键反应如下:
①
②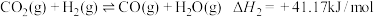
③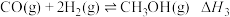
(1)反应③中ΔH3=___________ ,该反应的自发条件是___________ (填“高温自发”、“低温自发”或“任何温度下都自发”)。
(2)在催化剂作用下,按 的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为
的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为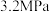 ,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
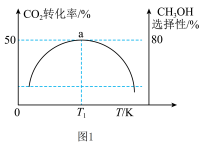
已知:甲醇的选择性=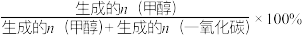 。
。
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是___________ 。
②在实际工业生产中压强不能过高也不能过低的原因是___________ 。
③T1K时,若反应从开始到达到a点所用时间为 ,则H2的分压=
,则H2的分压=___________ MPa,反应②的
Kp=___________ (Kp指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数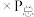 ,最终结果用分数表示)。
,最终结果用分数表示)。
Ⅱ.Al-CO2电池电容量大,能有效捕获利用CO2,其工作原理如图2所示。其中,离子液体是具有导电性的优良溶剂,O2是电极反应的催化剂,电池反应产物Al2(C2O4)3是重要的化工原料。
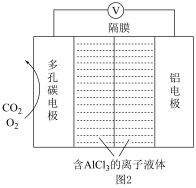
(3)该电池的正极反应式为___________ 。
I.利用CO2合成淀粉涉及的关键反应如下:
①

②
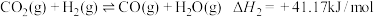
③
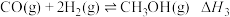
(1)反应③中ΔH3=
(2)在催化剂作用下,按
 的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为
的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为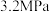 ,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
已知:甲醇的选择性=
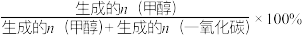 。
。①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是
②在实际工业生产中压强不能过高也不能过低的原因是
③T1K时,若反应从开始到达到a点所用时间为
 ,则H2的分压=
,则H2的分压=Kp=
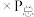 ,最终结果用分数表示)。
,最终结果用分数表示)。Ⅱ.Al-CO2电池电容量大,能有效捕获利用CO2,其工作原理如图2所示。其中,离子液体是具有导电性的优良溶剂,O2是电极反应的催化剂,电池反应产物Al2(C2O4)3是重要的化工原料。

(3)该电池的正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】按照要求回答下列问题。
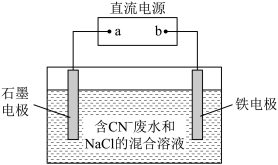
(1)工业上,在强碱性条件下用电解法除去废水中的 ,装置如图所示,依次发生的反应有:
,装置如图所示,依次发生的反应有:
i.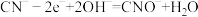
ii.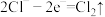
iii.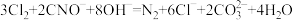
①a为电源_______ 极。
②通电过程中溶液pH不断_______ (填“增大”“减小”或“不变”)。
③除去0.1mol ,外电路中至少需要转移
,外电路中至少需要转移_______ mol电子。
④为了使电解池连续工作,需要不断补充_______ 、_______ 。(填化学式)
(2)用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一、Fe还原水体中的
)已成为环境修复研究的热点之一、Fe还原水体中的 的反应原理如图所示。
的反应原理如图所示。
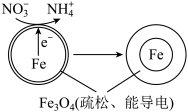
①作负极的物质是_______ 。
②正极的电极反应式是_______ 。
(3)通过 传感器可监测
传感器可监测 的含量,其工作原理示意图如图所示。
的含量,其工作原理示意图如图所示。
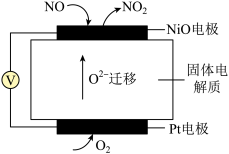
①Pt电极上发生的是_______ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:_______ 。
(1)工业上,在强碱性条件下用电解法除去废水中的
 ,装置如图所示,依次发生的反应有:
,装置如图所示,依次发生的反应有:
i.
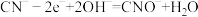
ii.
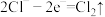
iii.
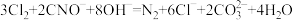
①a为电源
②通电过程中溶液pH不断
③除去0.1mol
 ,外电路中至少需要转移
,外电路中至少需要转移④为了使电解池连续工作,需要不断补充
(2)用零价铁(Fe)去除水体中的硝酸盐(
 )已成为环境修复研究的热点之一、Fe还原水体中的
)已成为环境修复研究的热点之一、Fe还原水体中的 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质是
②正极的电极反应式是
(3)通过
 传感器可监测
传感器可监测 的含量,其工作原理示意图如图所示。
的含量,其工作原理示意图如图所示。
①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】人类的一切活动都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
(1)已知:在25℃和101kPa条件下,断开1mol 中的化学键要吸收436kJ能量,断开lmol
中的化学键要吸收436kJ能量,断开lmol 中的化学键要吸收243kJ能量,断开1mol HCl中的化学键要吸收431kJ能量。则反应
中的化学键要吸收243kJ能量,断开1mol HCl中的化学键要吸收431kJ能量。则反应 中,生成1mol HCl时,该反应
中,生成1mol HCl时,该反应______ (填“吸收”或“放出”)______ kJ能量。
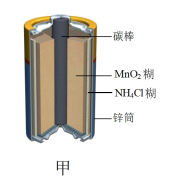
(2)有关的电池装置如下:_______ (填“正极”或“负极”)。
②乙装置中,外电路中电流的流向是_______ (填“从Zn流向Cu”或“从Cu流向Zn”)。
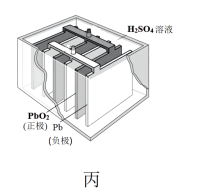
③丙装置中,铅蓄电池在放电时发生的电池反应式为 ,其中
,其中 难溶于水,则负极发生的电极反应式为
难溶于水,则负极发生的电极反应式为_________ 。
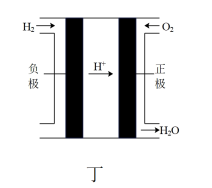
④燃料电池具有清洁、安全、高效等优点。某氢气燃料电池的工作原理如丁图所示,其电解质溶液为稀硫酸。正极的电极反应式为___________ 。如果该电池工作时电路中通过2mol电子,则消耗的 的体积为
的体积为_______ L(标准状况下)。
(1)已知:在25℃和101kPa条件下,断开1mol
 中的化学键要吸收436kJ能量,断开lmol
中的化学键要吸收436kJ能量,断开lmol 中的化学键要吸收243kJ能量,断开1mol HCl中的化学键要吸收431kJ能量。则反应
中的化学键要吸收243kJ能量,断开1mol HCl中的化学键要吸收431kJ能量。则反应 中,生成1mol HCl时,该反应
中,生成1mol HCl时,该反应(2)有关的电池装置如下:
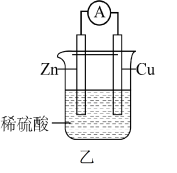
②乙装置中,外电路中电流的流向是
③丙装置中,铅蓄电池在放电时发生的电池反应式为
 ,其中
,其中 难溶于水,则负极发生的电极反应式为
难溶于水,则负极发生的电极反应式为④燃料电池具有清洁、安全、高效等优点。某氢气燃料电池的工作原理如丁图所示,其电解质溶液为稀硫酸。正极的电极反应式为
 的体积为
的体积为
您最近一年使用:0次



