CO2的转化和利用是实现碳中和的有效途径。回答下列问题。
I.利用CO2合成淀粉涉及的关键反应如下:
①
②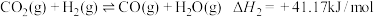
③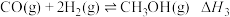
(1)反应③中ΔH3=___________ ,该反应的自发条件是___________ (填“高温自发”、“低温自发”或“任何温度下都自发”)。
(2)在催化剂作用下,按 的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为
的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为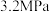 ,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
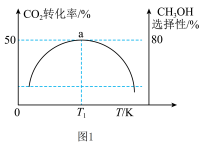
已知:甲醇的选择性=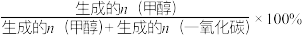 。
。
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是___________ 。
②在实际工业生产中压强不能过高也不能过低的原因是___________ 。
③T1K时,若反应从开始到达到a点所用时间为 ,则H2的分压=
,则H2的分压=___________ MPa,反应②的
Kp=___________ (Kp指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数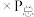 ,最终结果用分数表示)。
,最终结果用分数表示)。
Ⅱ.Al-CO2电池电容量大,能有效捕获利用CO2,其工作原理如图2所示。其中,离子液体是具有导电性的优良溶剂,O2是电极反应的催化剂,电池反应产物Al2(C2O4)3是重要的化工原料。
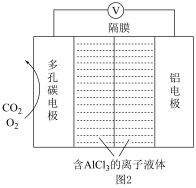
(3)该电池的正极反应式为___________ 。
I.利用CO2合成淀粉涉及的关键反应如下:
①

②
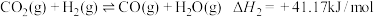
③
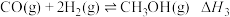
(1)反应③中ΔH3=
(2)在催化剂作用下,按
 的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为
的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为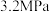 ,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
,测得不同温度下,反应经过相同时间时,CO2的转化率、甲醇的选择性如图1所示:
已知:甲醇的选择性=
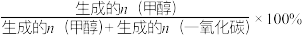 。
。①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是
②在实际工业生产中压强不能过高也不能过低的原因是
③T1K时,若反应从开始到达到a点所用时间为
 ,则H2的分压=
,则H2的分压=Kp=
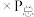 ,最终结果用分数表示)。
,最终结果用分数表示)。Ⅱ.Al-CO2电池电容量大,能有效捕获利用CO2,其工作原理如图2所示。其中,离子液体是具有导电性的优良溶剂,O2是电极反应的催化剂,电池反应产物Al2(C2O4)3是重要的化工原料。

(3)该电池的正极反应式为
更新时间:2023-12-31 19:58:55
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】天空不是垃圾场,污染气体不能随便排,研究大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-b kJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1)△H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式______________________________________ 。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:
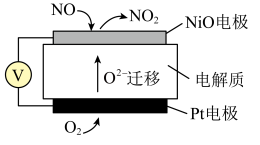
①NiO电极上发生的是_______________ 反应(填“氧化”或“还原”)。
②Pt电极上的电极反应式为_______________ 。
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
①请把表中数据补充完整:A_______________ ;B_______________ 。
②能验证温度对化学反应速率影响规律的是实验_______________ (填实验序号)。
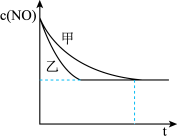
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________ (填“甲”或“乙”)。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-b kJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中放出的热量为
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1)△H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:

①NiO电极上发生的是
②Pt电极上的电极反应式为
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | B | 124 |
| Ⅲ | 350 | A | 5.80×10-3 | 82 |
②能验证温度对化学反应速率影响规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ⇌ CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
1/4CaSO4(s)+CO(g) ⇌ 1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s) + 3CO(g ) + SO2(g) ⇌ CaS(s) +3 CO2(g) ΔH=____________ 。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________ (填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。

①在0~2min内的平均反应速率v(CO)=____________ 。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________ 答出一条即可)。
③若要提高反应体系中CO2的体积分数,可采取的措施为__________________ 。
(4)一定温度下,向恒容密闭容器中加入CaSO4(s)和1molCO,下列能说明反应I和反应II同时发生的是________________ (填代号)。
a.反应后气体能使品红褪色
b.反应过程中,CO的体积分数逐渐减小
c.反应体系达平衡前,SO2和CO2两种气体的浓度之比随时间发生变化
d.体系压强逐渐增大
(5)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7K2=5.6×10-11
亚硫酸 K1=1.5×10-2K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是__________ (填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________ 。
③H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为____________________________ 。
CaSO4(s)+CO(g) ⇌ CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
1/4CaSO4(s)+CO(g) ⇌ 1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s) + 3CO(g ) + SO2(g) ⇌ CaS(s) +3 CO2(g) ΔH=
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。

①在0~2min内的平均反应速率v(CO)=
②曲线B表示过程与曲线A相比改变的反应条件可能为
③若要提高反应体系中CO2的体积分数,可采取的措施为
(4)一定温度下,向恒容密闭容器中加入CaSO4(s)和1molCO,下列能说明反应I和反应II同时发生的是
a.反应后气体能使品红褪色
b.反应过程中,CO的体积分数逐渐减小
c.反应体系达平衡前,SO2和CO2两种气体的浓度之比随时间发生变化
d.体系压强逐渐增大
(5)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7K2=5.6×10-11
亚硫酸 K1=1.5×10-2K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=
③H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
【推荐3】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
(1)方法1:以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
第1步:2NH3(g)+CO2(g) NH2COONH4(s) ∆H1=-159.47kJ•mol-1
NH2COONH4(s) ∆H1=-159.47kJ•mol-1
第2步:……
①第2步反应的热化学反应方程式为_________ 。
②一定条件下的恒容容器中,充入1.5molNH3和1molCO2,平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)=_______ ,已知第2步反应的Kp=mkPa,测得平衡时容器内总压为3mkPa,则反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=________ 。
③若要提高NH3平衡转化率,可采取的措施有_______ (任写一条)。
(2)方法2:电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:
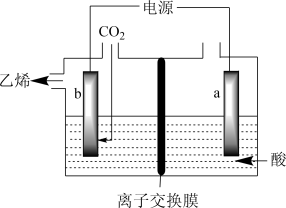
阴极电极反应式为________ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
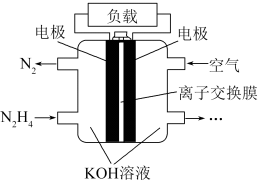
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为________ ,正极反应式为________ 。
(1)方法1:以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。第1步:2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1=-159.47kJ•mol-1
NH2COONH4(s) ∆H1=-159.47kJ•mol-1第2步:……
①第2步反应的热化学反应方程式为
②一定条件下的恒容容器中,充入1.5molNH3和1molCO2,平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)=
 CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=③若要提高NH3平衡转化率,可采取的措施有
(2)方法2:电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:

阴极电极反应式为
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

您最近一年使用:0次
【推荐1】汽车尾气中含有氨氧化合物、 和CO等,减少它们在大气中的排放是环境保护的重要内容之一。
和CO等,减少它们在大气中的排放是环境保护的重要内容之一。
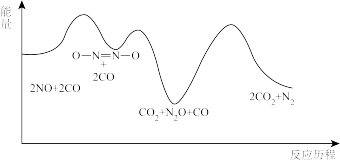
(1)一定条件,反应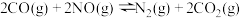 的反应历程如图所示,该历程分步进行,其中第
的反应历程如图所示,该历程分步进行,其中第_______ 步是决速步骤。
(2)在恒温恒容密闭容器中进行上述反应,原料组成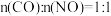 ,体系达到平衡时
,体系达到平衡时 的体积分数为25%,则CO的平衡转化率=
的体积分数为25%,则CO的平衡转化率=_______ 。
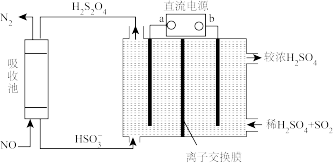
(3)氮的氧化物脱除可用电化学原理处理,如下图装置可同时吸收 和NO。已知:
和NO。已知: 是一种弱酸。直流电源的正极为
是一种弱酸。直流电源的正极为_______ (填“a”或“b”),阴极的电极反应式_______ 。该电解装置选择_______ (填“阳”或“阴”)离子交换膜。
中国提出要实现“二氧化碳排放力争于2030年前达到峰值,争取在2060年前实现碳中和”的目标,二氧化碳的资源化利用对实现碳中和目标具有促进作用。
(4)在一定条件下,向体积为2L的恒容密闭容器中通入1mol 和3mol
和3mol ,发生反应
,发生反应 ,测得
,测得 和
和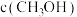 随时间变化如图所示。
随时间变化如图所示。

①M点时,
_______  。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
②下列叙述中一定能说明该反应达到平衡状态的是_______ 。
A.化学反应速率关系: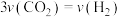
B.容器内混合气体的密度不再改变
C.单位时间内,每断裂2个C=O键,同时断裂3个O-H键
D.容器内混合气体的平均摩尔质量不再改变
 和CO等,减少它们在大气中的排放是环境保护的重要内容之一。
和CO等,减少它们在大气中的排放是环境保护的重要内容之一。
(1)一定条件,反应
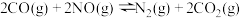 的反应历程如图所示,该历程分步进行,其中第
的反应历程如图所示,该历程分步进行,其中第(2)在恒温恒容密闭容器中进行上述反应,原料组成
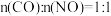 ,体系达到平衡时
,体系达到平衡时 的体积分数为25%,则CO的平衡转化率=
的体积分数为25%,则CO的平衡转化率=(3)氮的氧化物脱除可用电化学原理处理,如下图装置可同时吸收
 和NO。已知:
和NO。已知: 是一种弱酸。直流电源的正极为
是一种弱酸。直流电源的正极为
中国提出要实现“二氧化碳排放力争于2030年前达到峰值,争取在2060年前实现碳中和”的目标,二氧化碳的资源化利用对实现碳中和目标具有促进作用。
(4)在一定条件下,向体积为2L的恒容密闭容器中通入1mol
 和3mol
和3mol ,发生反应
,发生反应 ,测得
,测得 和
和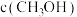 随时间变化如图所示。
随时间变化如图所示。
①M点时,

 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)②下列叙述中一定能说明该反应达到平衡状态的是
A.化学反应速率关系:
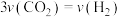
B.容器内混合气体的密度不再改变
C.单位时间内,每断裂2个C=O键,同时断裂3个O-H键
D.容器内混合气体的平均摩尔质量不再改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物在生产,生活中有着重要的作用。
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
分析数据可知:大气固氮反应属于_________ (填“吸热”或“放热”)反应,人类不适合大规模模拟大气固氮的原因是______________________________________ 。
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下: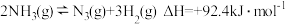 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________ (用a、b、c表示)。b点氮气的百分含量高于c点的原因是______ 。

(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为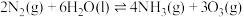 ,该条件下,向一体积为
,该条件下,向一体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和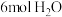 ,
,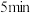 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率 ,则平衡时
,则平衡时 的转化率为
的转化率为______________ ,则常温下该反应的化学平衡常数
________________ 。(保留小数点后2位)
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气: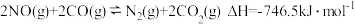 ,将
,将 与
与 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第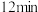 时改变的反应条件可能为
时改变的反应条件可能为____________ (填序号)。

A.保持恒温恒容充入 气
气
B.保持恒容,降低温度
C.移走
D.保持恒温,缩小容器体积,增大压强
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 | 工业固氮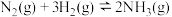 | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K |  | 0.1 | 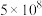 | 0.507 | 0.152 |
分析数据可知:大气固氮反应属于
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下:
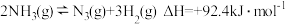 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是
(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为
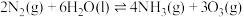 ,该条件下,向一体积为
,该条件下,向一体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和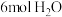 ,
,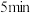 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率 ,则平衡时
,则平衡时 的转化率为
的转化率为
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气:
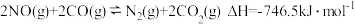 ,将
,将 与
与 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第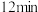 时改变的反应条件可能为
时改变的反应条件可能为
A.保持恒温恒容充入
 气
气 B.保持恒容,降低温度
C.移走

D.保持恒温,缩小容器体积,增大压强
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种可再生能源,具有广阔的开发和应用前景,回答下列问题:
(1)在一定条件下将 和
和 转化为甲醇蒸气的相关反应有:
转化为甲醇蒸气的相关反应有:
ⅰ:

 ;
;
ⅱ:

 ;
;
ⅲ:

 。
。
则
________ (用含 、
、 的代数式表示),
的代数式表示),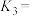
________ (用含 、
、 的代数式表示)。
的代数式表示)。
(2)不同温度下,在3个体积均为1.0L的恒容密闭容器中仅发生反应
 ,其浓度变化如表所示。
,其浓度变化如表所示。
该反应达到平衡时:
①对于容器I,若5min后该反应达到平衡,此时CO的平衡转化率为0~5min内,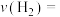
___________  。
。
②对于容器Ⅱ,该反应达到平衡时的平衡常数
___________ 。
③
___________ (填“>”、“<”或“=”)0,判断的理由为___________ 。
(1)在一定条件下将
 和
和 转化为甲醇蒸气的相关反应有:
转化为甲醇蒸气的相关反应有:ⅰ:


 ;
;ⅱ:


 ;
;ⅲ:


 。
。则

 、
、 的代数式表示),
的代数式表示),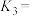
 、
、 的代数式表示)。
的代数式表示)。(2)不同温度下,在3个体积均为1.0L的恒容密闭容器中仅发生反应

 ,其浓度变化如表所示。
,其浓度变化如表所示。| 容器 | 温度/K | 物质的起始浓度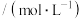 | 物质的平衡浓度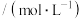 | ||
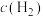 | 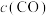 | 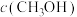 | 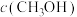 | ||
| I | 400 | 0.20 | 0.10 | 0 | 0.08 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | x |
| Ⅲ | 500 | 0.20 | 0.10 | 0 | 0.025 |
①对于容器I,若5min后该反应达到平衡,此时CO的平衡转化率为0~5min内,
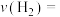
 。
。②对于容器Ⅱ,该反应达到平衡时的平衡常数

③

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】某冶炼厂产生大量的CO、SO2等有毒废气,为了变废为宝,科研小组研究用废气等物质制备羰基硫(COS)和Li/SO2电池产品。
(1)I.羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害,利用CO等制备羰基硫原理如下。
方法一:用FeOOH作催化剂,发生反应:CO(g)+H2S(g)⇌COS(g)+H2(g) ΔH= -11.3kJ/mol,反应分两步进行,其反应过程能量变化如图所示。
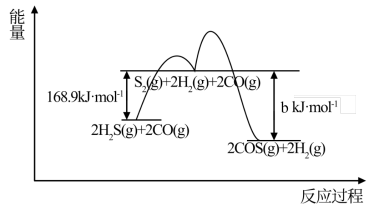
①决定COS生成速率的主要步骤是_______ (填“第1步”或“第2步”)。
②计算b的数值为_______ 。
Ⅱ.方法二:一氧化碳还原CaSO4。可发生下列反应:
Ⅰ. CaSO4(s)+CO(g)⇌CaO(s)+CO2(g)+SO2(g),Ⅱ. SO2(g)+3CO(g)⇌2CO2(g)+COS(g),其lg Kp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数,Kp对应的分压单位为Kpa)。

①比较键角:SO2_______ COS(填“>”,“<”或“=”)
② H>0的反应是
H>0的反应是_______ 。(填“Ⅰ”或“Ⅱ”)
③上述反应体系在一定条件下建立平衡后,下列说法正确的有_______ 。
A.增大CO和SO2的浓度,反应I和Ⅱ的正反应速率都增加
B.移去部分CaSO4(s),反应I的平衡向左移动
C.加入反应I的催化剂,可提高COS的平衡产率
D.降低温度,反应I和Ⅱ中的活化分子百分数降低
④写出一种一定能同时提高COS平衡产量和总反应速率的操作:_______ 。
⑤若在某恒容密闭容器中加入1mol CaSO4固体和一定量的CO气体,只发生反应I,在B点温度下达到平衡时,CO的分压为100kPa,则CO的平衡转化率为_______ 。
(2)利用SO2等物质制备Li/SO2电池。电池以LiBr-AN(乙腈)、液态SO2为电解质溶液,放电时有白色的连二亚硫酸锂(Li2S2O4)沉淀生成。写出正极的电极反应式为_______ 。
(1)I.羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害,利用CO等制备羰基硫原理如下。
方法一:用FeOOH作催化剂,发生反应:CO(g)+H2S(g)⇌COS(g)+H2(g) ΔH= -11.3kJ/mol,反应分两步进行,其反应过程能量变化如图所示。

①决定COS生成速率的主要步骤是
②计算b的数值为
Ⅱ.方法二:一氧化碳还原CaSO4。可发生下列反应:
Ⅰ. CaSO4(s)+CO(g)⇌CaO(s)+CO2(g)+SO2(g),Ⅱ. SO2(g)+3CO(g)⇌2CO2(g)+COS(g),其lg Kp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数,Kp对应的分压单位为Kpa)。

①比较键角:SO2
②
 H>0的反应是
H>0的反应是③上述反应体系在一定条件下建立平衡后,下列说法正确的有
A.增大CO和SO2的浓度,反应I和Ⅱ的正反应速率都增加
B.移去部分CaSO4(s),反应I的平衡向左移动
C.加入反应I的催化剂,可提高COS的平衡产率
D.降低温度,反应I和Ⅱ中的活化分子百分数降低
④写出一种一定能同时提高COS平衡产量和总反应速率的操作:
⑤若在某恒容密闭容器中加入1mol CaSO4固体和一定量的CO气体,只发生反应I,在B点温度下达到平衡时,CO的分压为100kPa,则CO的平衡转化率为
(2)利用SO2等物质制备Li/SO2电池。电池以LiBr-AN(乙腈)、液态SO2为电解质溶液,放电时有白色的连二亚硫酸锂(Li2S2O4)沉淀生成。写出正极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】随着新能源汽车销量逐年攀升,动力电池的制备和回收利用技术至关重要。利用含 的锂电池废料回收制备
的锂电池废料回收制备 的流程图如下:
的流程图如下:
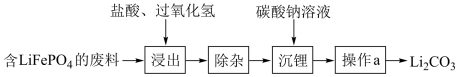
(1)含 的废料在浸出操作之前要进行粉碎,其作用是
的废料在浸出操作之前要进行粉碎,其作用是_______ 。
(2)浸出过程中温度不宜高于40℃,原因是_______ 。
(3)操作a的名称为_______ 。
(4)欲证明 产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)
产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)_______ °
(5)工业通过处理含 的废旧电池正极材料可以回收Li,Li可用于空气中
的废旧电池正极材料可以回收Li,Li可用于空气中 的固定,其工作原理为:
的固定,其工作原理为: 。该电池的正极反应式为
。该电池的正极反应式为_______ 。反应中当有3 mol氧化剂被还原,通过交换膜的 的物质的量为
的物质的量为_______ mol。
 的锂电池废料回收制备
的锂电池废料回收制备 的流程图如下:
的流程图如下:
(1)含
 的废料在浸出操作之前要进行粉碎,其作用是
的废料在浸出操作之前要进行粉碎,其作用是(2)浸出过程中温度不宜高于40℃,原因是
(3)操作a的名称为
(4)欲证明
 产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)
产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)(5)工业通过处理含
 的废旧电池正极材料可以回收Li,Li可用于空气中
的废旧电池正极材料可以回收Li,Li可用于空气中 的固定,其工作原理为:
的固定,其工作原理为: 。该电池的正极反应式为
。该电池的正极反应式为 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有广阔的开发和应用前景,研究甲醇具有重要意义。
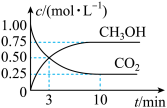
(1)利用工业废气中的CO2可制取甲醇,其反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在恒温条件下,向一容积为1 L的密闭容器中,充入1mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示。从反应开始到达平衡状态,v(H2)=_______ ;该温度下的平衡常数K=_______ (mol·L-1)-2 。能使平衡体系中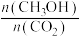 增大的措施有
增大的措施有_______ (任写一条)。
(2)工业上利用甲醇制备氢气。主要反应为CH3OH(g)⇌CO(g)+2H2(g)。设在容积为2.0 L的密闭容器中充入0.60mol CH3OH(g),体系压强为p1,在一定条件下达到平衡状态时,体系压强为p2,且 =2.2,则该条件下CH3OH(g)的平衡转化率为
=2.2,则该条件下CH3OH(g)的平衡转化率为_______ 。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有 ),实验室利用如图装置模拟该方法:
),实验室利用如图装置模拟该方法:
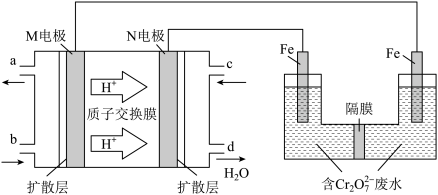
①M电极为电池的_______ (填“正”或“负”)极,N电极的电极反应式为_______ 。
②请完成电解池中 转化为Cr3+的离子方程式:
转化为Cr3+的离子方程式:
_______ + _______Fe2++_______= _______Cr3++ _______Fe3++ _______。
+ _______Fe2++_______= _______Cr3++ _______Fe3++ _______。
_______
(1)利用工业废气中的CO2可制取甲醇,其反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在恒温条件下,向一容积为1 L的密闭容器中,充入1mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示。从反应开始到达平衡状态,v(H2)=
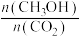 增大的措施有
增大的措施有
(2)工业上利用甲醇制备氢气。主要反应为CH3OH(g)⇌CO(g)+2H2(g)。设在容积为2.0 L的密闭容器中充入0.60mol CH3OH(g),体系压强为p1,在一定条件下达到平衡状态时,体系压强为p2,且
 =2.2,则该条件下CH3OH(g)的平衡转化率为
=2.2,则该条件下CH3OH(g)的平衡转化率为(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有
 ),实验室利用如图装置模拟该方法:
),实验室利用如图装置模拟该方法:
①M电极为电池的
②请完成电解池中
 转化为Cr3+的离子方程式:
转化为Cr3+的离子方程式:_______
 + _______Fe2++_______= _______Cr3++ _______Fe3++ _______。
+ _______Fe2++_______= _______Cr3++ _______Fe3++ _______。
您最近一年使用:0次



